






人教版九年级上册课题 3 利用化学方程式的简单计算教学演示课件ppt
展开一、创设情景 明确目标
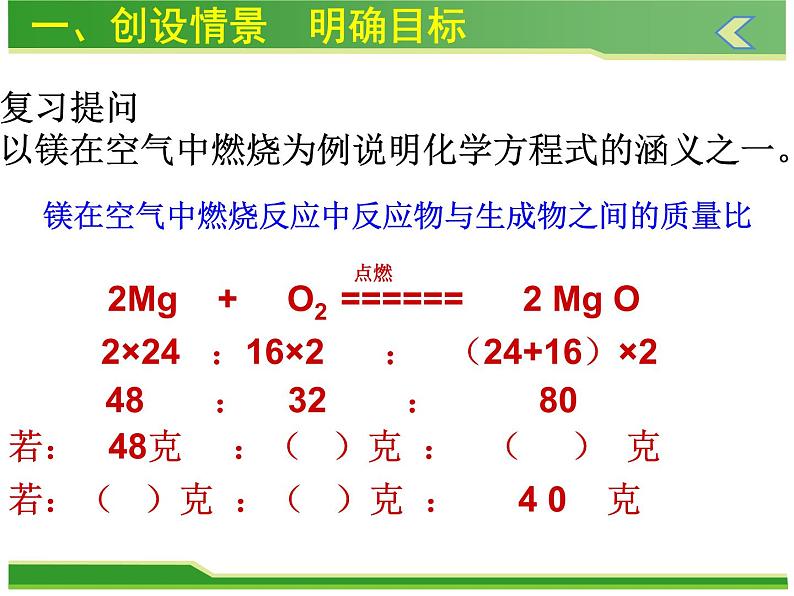
复习提问以镁在空气中燃烧为例说明化学方程式的涵义之一。
镁在空气中燃烧反应中反应物与生成物之间的质量比
2×24 :16×2 : (24+16)×2
48 : 32 : 80
若: 48克 :( )克 : ( ) 克
若:( )克 :( )克 : 4 0 克
二、自主学习 指向目标
自读课本P102完成《名师学案》知识储备。
三、合作探究 达成目标
探究点:利用化学方程式进行计算
说明:在化学反应中,反应物与生成物之间的质量比是成正比例关系。因此,利用正比例关系根据化学方程式和已知的一种反应物(或生成物)的质量,可求生成物(或反应物)的质量。
[例题]:3克镁在氧气中充分燃烧,可以生成多少克氧化镁?
解:设可生成氧化镁的质量为X。
(1)设未知数 … …….….设
2 Mg + O 2 ====== 2 Mg O
48 803克 X
(2)写出化学方程式…...…..写
------ = ------
(4) 写比例式,求解.….……..比
X = ------------
答:3克镁在氧气中充分燃烧可生成氧化镁 5 克。
….. …... …………………………….解
(5) 简明地写出答案…..…...答
(3)列出相关数据 …...…..列
根据化学方程式计算的注意事项:(1) 根据物质的组成及化学方程式求各化学式的相对分子质量(或相对原子质量)与化学式前边计量数的乘积,计算时必须准确无误。(2) 解题格式的书写要规范化。(3) 注意单位的书写要求。
------- = ---------
练习:15.5克红磷在氧气中充分燃烧,可 生成五氧化二磷多少克?
(找出下列所解答案中的错误)
解:设可生成X克五氧化二磷。 点燃P + O 2 ====== P 2 O 5
31 14215.5 X
31 15.5
142 X
X = --------------
答:可生成五氧化二磷71克。
③相对分子(或原子) 质量之和计算错误
⑤计算结果错误且无单位
④未注明单位, 未带单位计算
【教师点拨】1.根据化学方程式进行计算的格式,初学时老师一定要规范,否则以后很难改正。2.化学方程式的计算是从量的方面对化学反应进行研究。
【一试身手】请同学们完成《名师学案》基础练、综合练。
将含3克氯酸钾和1克二氧化锰的混合物加热片刻,冷却,称得残余固体的质量为3.04克,根据质量守恒定律可知,生成氧气的质量为多少克?固体残余物中含有什么物质?质量各为多少?
思路:反应中固体物质质量减轻了,原来3克+1克=4克,加热片刻后剩余固体3.04克,固体质量为什么会减轻?减轻了多少?此减轻的是什么物质的质量?
根据题意,加热片刻生成氧气4克-3.04克=0.96克
设参加反应的KClO3的质量为X,反应生成KCl的质量为Y。
∴反应后固体残余物中 剩余KClO3 3克-2.45克=0.55克 生成KCl 1.49克 有MnO2 1克
四、总结梳理 内化目标
1、根据化学方程式计算的依据。2、根据化学方程式计算一般分为五个步骤:①设未知量②写出正确的化学方程式③算出已知量和未知量的质量比④列、解比例式⑤写出简明的答案。【易错易混提示】 1.化学方程式书写必须正确,尤其要重视化学式中的角标和化学方程式各化学式前的系数。2.有关物质的相对分子质量及物质间的质量比要计算准确,当物质的化学式前出现不为1的系数时,要注意相对分子质量总和的计算——必须用物质的相对分子质量去乘以系数。3.遇到某物质是混合物时,只能将其中纯净物的质量代入化学方程式计算,不能直接将混合物的质量代入。4.要注意挖掘隐蔽性的已知条件,这往往是解题的突破口。
五、达标检测 反思目标
1.相等质量的下列物质,在氧气中完全燃烧,消耗氧气最多的是 ( )A.氢气 B.红磷 C.硫 D.铁2.相等质量的铁和锌分别与足量的稀盐酸反应,已知反应的化学方程式为:Fe+2HCl=FeCl2+H2↑, Zn+2HCl=ZnCl2+H2↑。则生成氢气的质量是 ( )A.相等 B.铁大于锌 C.铁小于锌 D.无法比较
思路:写出反应方程式,作适当的变形,使氧气化学式前的计量数相等(都为1),然后观察比较,一般不必算出最后结果。
Fe+2HCl = FeCl2+H2↑ Zn+2HCl = ZnCl2+H2↑
3.加热15.8g高锰酸钾,当产生1.6g氧气时,固体剩余物的成分 是 ( )A.K2MnO4和MnO2 B.KMnO4、K2MnO4和MnO2C.KMnO4和MnO2 D.KMnO4和K2MnO4
思路:根据氧气的质量来求生成这么多氧气需要分解多少克高锰酸钾。要注意到15.8克高锰酸钾有可能没有全部分解。所以15.8克这个数据在此不能直接用于计算。
解:设生成1.6克氧气需要分解高锰酸钾的质量为x。
4.下列关于氢气在氧气中燃烧的叙述中正确的是 ( ) A.16g 氢气和2g 氧气反应能生成18g 水 B.9g 氢气和9g 氧气反应能生成18g 水 C.1g 氢气和8g 氧气反应能生成9g 水 D.8g 氢气和1g 氧气反应能生成9g 水
5、在2X + Y2 === 2Z的反应中,X的相对原子质量为24,Y2的相对分子质量为32,Z的相对分子质量是 ( )
A.64 B.56 C.40 D.32
反应前后有三种物质,已知其中二种物质的质量(或相对质量),求第三种物质的质量(或相对质量)。
解:设Z的相对分子质量为X。
2×24 + 32 = 2×X
初中化学课题 3 利用化学方程式的简单计算图文ppt课件: 这是一份初中化学<a href="/hx/tb_c28893_t3/?tag_id=26" target="_blank">课题 3 利用化学方程式的简单计算图文ppt课件</a>,共20页。
人教版九年级上册课题 3 利用化学方程式的简单计算说课课件ppt: 这是一份人教版九年级上册课题 3 利用化学方程式的简单计算说课课件ppt,共15页。PPT课件主要包含了学习目标,设未知量,×2×16,列比例式求解,×158,x06g,简明地写出答案,4kg,x85kg,×34等内容,欢迎下载使用。
初中化学人教版九年级上册课题 3 利用化学方程式的简单计算教学演示ppt课件: 这是一份初中化学人教版九年级上册课题 3 利用化学方程式的简单计算教学演示ppt课件,共15页。PPT课件主要包含了化学方程式的意义,②表示反应条件,质的意义,量的意义,导入新课,上标相对分子质量,下标已知量和未知量,相对分子质量,归纳总结,三个要领等内容,欢迎下载使用。













