






化学人教版第八单元 金属和金属材料课题 2 金属的化学性质教学演示ppt课件
展开化学性质一:能和氧气反应
想一想:你学过哪些金属与氧气的反应?说一说反应现象,写一写方程式
2Mg+O2===2MgO
2Cu+O2===2CuO
3Fe+2 O2 ===Fe3 O4
4Al+3O2===2Al2O3
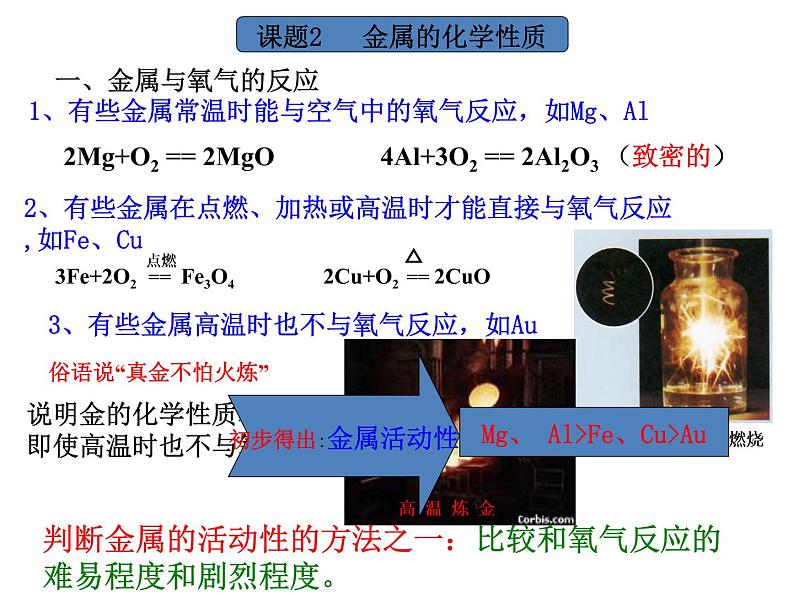
1、有些金属常温时能与空气中的氧气反应,如Mg、Al
2Mg+O2 == 2MgO 4Al+3O2 == 2Al2O3 (致密的)
2、有些金属在点燃、加热或高温时才能直接与氧气反应,如Fe、Cu
说明金的化学性质稳定,即使高温时也不与氧气反应。
俗语说“真金不怕火炼”
3、有些金属高温时也不与氧气反应,如Au
判断金属的活动性的方法之一:比较和氧气反应的难易程度和剧烈程度。
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
讨论:金属与氧气反应的规律
铝的化学性质活泼,为什么我们通常没有见到铝被锈蚀?
金属铝在常温下发生缓慢氧化:4Al+3O2=2Al2O3在铝的表面形成一层致密的氧化铝薄膜,从而阻止铝进一步氧化,因此,铝具有抗腐蚀性。
为何不宜用钢刷来擦洗铝制餐具呢?
若用钢刷擦洗铝制品,容易把氧化铝薄膜除掉,从而失去了保护作用,所以用布擦洗好。
化学性质二:能和酸反应
A组:在试管中分别放入镁条、锌粒、铁丝、铜丝。然后,分别向其中加入一些稀盐酸。
B组:在试管中分别放入镁条、锌粒、铁丝、铜丝。然后,分别向其中加入一些稀硫酸。
注意观察试管内壁上的变化,和比较反应速度
剧烈反应,产生大量气泡
反应缓慢,有气泡产生,溶液由无色变为浅绿色
Mg + H2 SO4 = MgSO4 + H2 ↑
Mg + 2HCl = MgCl2 + H2 ↑
Zn + H2 SO4 == Zn SO4 + H2 ↑
Zn + 2HCl == ZnCl2 + H2 ↑
Fe + H2 SO4 == Fe SO4 + H2 ↑
Fe + 2HCl == FeCl2 + H2 ↑
1、金属能否和稀盐酸、稀硫酸反应?
2、根据反应的剧烈程度,排出这几种金属的活动性。
3、该实验如果用的酸浓度不同,能否具有说服力?
4、怎样总结叙述这种比较金属活动性强弱的方法?
5、以下反应的反应物和生成物属于哪种类别?
一种_____和一种______反应,生成另一种_____和另一种 _____ 的反应叫做置换反 应
你还能举出哪些置换反应的例子?
以下反应是不是置换反应,为什么?
说出化合反应: 分解反应:
由两种或两种以上物质,反应生成一种物质的反应。
由一种物质,分解生成两种或两种以上物质的反应。
化合反应、分解反应是从哪个角度定义的?
置换反应是从哪个角度定义的?
化合、分解只看物质的数目,不看类别,置换反应既看数目又看类别
请归纳总结出金属的两条化学性质及比较金属活动性强弱的两种方法。
金属与酸的反应的剧烈程度
Mg> Zn> Fe> Cu
1、判断下列反应的正误,并改正。
4Fe + 3O2 === 2Fe2O3
2Fe + 6HCl = 2FeCl3 + 3H2↑
Cu + 2HCl = CuCl2 + H2↑
(1)只要有单质和化合物参加的反应一定是置换反应
(2)只要有单质和化合物生成的反应一定是置换反应
一氧化碳燃烧、甲烷燃烧等
过氧化氢分解、高锰酸钾分解等
化学性质三:能和某些化合物溶液反应
回忆:铁和硫酸铜溶 液反应的现象:
铁钉表面有红色物质生成,蓝色溶液变成浅绿色.
观察铝与硫酸铜溶液反应: 铜与硝酸银溶液反应:
你能描述一下观察到的现象吗?写出反应方程式(标着化合价)
2Al + 3CuSO4= Al2(SO4)3 + 3Cu
Cu +2Ag NO3 =Cu(NO3)2 + 2Ag
铝片表面出现红色物质,溶液由蓝色变为无色。
铜丝表面出现银白色物质,溶液由无色逐渐变为蓝色。
以上反应属于哪种基本反应类型?
你能通过以上反应,比较出铜、银、铝的活动性强弱吗?
比较金属的活动性方法之三 将一种金属浸入另一种金属的化合物溶液中,看是否能将对方置换出来。
实验一:说明___的活动性强于_____
铝丝表面覆盖一层红色物质,溶液由蓝色变成无色
铜丝表面覆盖一层黑色物质,溶液由无色逐渐变成蓝色
2Al + 3 CuSO4 == Al2( SO4)3+ 3Cu
Cu + 2AgNO3 == Cu(NO3)2 + 2Ag
实验二:说明 ____的活动性强于 _____
实验三:说明_____的活动性弱于_____
结论:金属活动性顺序______________________
金属与化合物溶液的反应
1、在金属活动性顺序表里,金属的位置越靠前,它的活动性越强。
2、在金属活动性顺序表里,位于氢前面的金属能置换出盐酸,稀硫酸中的氢。
3、在金属活动性顺序里,位于前面的金属能把位于后面的金属从它的化合物溶液里置换出来。
三、常见金属的活动性顺序表
用自己的话说一说,你对这三种用法的理解
判断下列物质能否发生反应?若能,写出相关化学方程式。 (1)银与稀盐酸 (2)锌与硫酸铜溶液 (3)铜与硫酸锌溶液 (4)铝与硝酸银溶液 (5)银与氯化铜溶液 (6)镁与硫酸亚铁溶液
解答:可发生反应的:(2)(4)(6)
(2)Zn + CuSO4 = Cu + ZnSO4
(4)Al +3AgNO3 = Al(NO3)3 + 3Ag
(6)Mg + FeSO4 = MgSO4 +Fe
一. 金属与氧气的反应
4Al+3O2=2Al2O32Mg+O2=2MgO3Fe+2 O2 点燃 Fe3 O4
二.金属与稀盐酸、稀硫酸反应
Fe + 2HCl = FeCl2 + H2 ↑Fe + H2 SO4 = Fe SO4 + H2 ↑Zn + 2HCl = ZnCl2 + H2 ↑ Zn + H2 SO4 = Zn SO4 + H2 ↑Mg + 2HCl = MgCl2 + H2 ↑Mg + H2 SO4 = Mg SO4 + H2 ↑
三.金属与某些化合物溶液反应
2Al + 3 CuSO4 == Al2( SO4 )3+ 3CuCu + 2AgNO3== Cu (NO3 )2 + 2Ag
四.置换反应:由单质和化合物反应,生成单质和化合物 的反应。
五.金属活动性顺序: K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
金属活动性,由强逐渐减弱。
比较金属活动性强弱的方法(一)
比较金属活动性强弱的方法(二)
比较金属活动性强弱的方法(三)
1、 有X、Y、Z三种金属,如果把这三种金属均投入到稀硫酸中,X、Y表面均无明显现象,Z表面有大量气泡产生。若将X、Y这两种金属放在氧气中加热,X表面无明显现象,Y表面发黑。则这三种金属活动性顺序为( )
A、X>Y>Z B、Z>Y>XC、Y>X>Z D、Z>X>Y
2、波尔多液是一种农业上常用的杀菌剂,它是由硫酸铜、熟石灰加水配置而成,为什么不能用铁制容器来配置波尔多液?3、有X、Y、Z三种金属,如果把X和Y分别放入稀硫酸中,X溶解并产生氢气,Y不反应;如果把Y和Z分别放入硝酸银溶液中,过一会儿,在Y表面有银析出而Z没有变化。根据以上实验事实,判断X、Y和Z的金属活动性顺序。
因为Fe能和CuSO4溶液发生置换反应
4、下列物质不能由金属和酸反应直接生成的是( ) A、 ZnCl2 B、 CuSO4 C 、FeCl3 D 、Al2(SO4)3
市场上很多不法分子利用黄铜(铜、锌合金)来冒充黄金牟取暴利。请你设计实验,鉴别区分戒指是黄金还是黄铜。
其中的Cu在加热时能和氧气反应生成黑色的氧化铜
其中的Zn能和稀盐酸或稀硫酸反应生成氢气
将戒指与黄铜相互刻画,软的是黄金
测戒指的密度,然后与纯金的密度比较。
用火烧烤片刻,变黑的是黄铜,不变色的是黄金。
将戒指投入到稀盐酸或稀硫酸中观察,表面有气泡冒出的是黄铜,不反应的是黄金。
鉴别区分物质,就要熟悉物质的性质!
Fe + H2SO4 = FeSO4 +H2↑
Fe + 2HCl= FeCl2 + H2↑
铜粉中混有铁粉,可以采用怎样的方法除去?
Fe + CuSO4 = FeSO4 +Cu
Cu不能被磁铁吸引而Fe能被磁铁吸引。
Cu不跟CuSO4溶液反应而Fe能跟CuSO4溶液反应
Cu不能跟稀盐酸、稀硫酸反应,而Fe 能跟稀盐酸稀硫酸反应。
将Cu、Fe混合物放入到足量稀盐酸或稀硫酸中,反应完毕后过滤、洗涤。
将Cu、Fe混合物放入到足量CuSO4溶液中,反应完毕后过滤。
问题一:在方法(二)的操作过程中,使用足量稀盐酸或稀硫酸的目的是什么? 怎样知道铁粉被完全反应掉了?
问题二:两种方法相比,哪种方法更好?为什么?
为了将铁粉全部反应掉。
当固体表面再没有气泡冒出时,说明铁粉被全部反应掉了。
后一种,可回收溶液中的铜
5、填写下列表格。(“混合物”栏中括号内为杂质)
加适量硫酸至无气泡产生,过滤,洗涤,干燥。
Fe + CuCl2 = FeCl2 + Cu
加适量无锈铁钉或铁粉、过滤
如果用最简单的方法,证明锌、银、铜的活动性顺序,至少需要选用下列物质的________.(1)Zn (2)Ag (3)Cu (4)CuSO4 溶液 (5)稀硫酸 (6)AgNO3 (7)ZnSO4 溶液
练习二:比较金属的活动性强弱
将Zn、Ag分别浸入CuSO4 溶液中,Zn表面析出红色的Cu,说明Zn>Cu; Ag表面无Cu析出,说明Cu>Ag。综上所得可知Zn>Cu;>Ag
将两种金属的单质,浸入活动性位于中间的那种金属的化合物溶液中。这样设计最简单。
将Cu分别浸入AgNO3溶液和ZnSO4 溶液中, Cu表面析出银白色的Ag,说明Cu>Ag; Cu表面无Zn析出,说明Zn>Cu。综上所得可Zn>Cu;>Ag
将活动性位于中间的那种金属的单质,分别浸入另两种金属的化合物溶液中。这样设计也简单。
练习三:比较金属与酸的反应
分别取质量相同的铝、锌、镁、铁四种金属,浸入相等浓度的稀硫酸(或稀盐酸)中。
根据“金属活动性顺序表”可知,活动性强弱顺序为Mg>Al>Zn>Fe,故金属表面冒出气泡的速度也是Mg>Al>Zn>Fe。
金属的活动性越强,反应速度越快。
设取质量都为10g。根据反应方程式分别计算生成多少氢气?(注意只要计算到最终算式即可)Mg:24 Al:27 Zn:65 Fe:56 H:1
2Al + 3H2SO4= Al2(SO4)3 + 3H2 ↑
Mg + H2SO4= MgSO4 + H2 ↑
Fe + H2SO4= FeSO4 + H2 ↑
Zn + H2SO4= ZnSO4 + H2 ↑
质量相同时,生成氢气由多到少为Al>Mg>Fe>Zn;化合价相等的金属,相对原子质量越大的生成氢气反而越少。
中考题: 相同质量的Mg、Zn、Fe和足量的稀硫酸反应,产生氢气的总质量(m)随时间(t)变化的关系如下图,则下图中a、b、c表示的金属分别为:
这样图示是否正确?为什么?
切记:与时间轴夹角越大,说明生成氢气的速度越快; 在看图时,必须既要看生成氢气的速度快慢,又要看生成氢气多少。
等质量的M、N两种金属,分别与相同质量分数的足量稀盐酸反应(已知M、N在生成物中均为+2价),生成氢气质量和反应时间的关系如右图所示,下列叙述正确的是( )A.M、N两种金属中较活泼的是NB.生成H2的质量M<NC.相对原子质量较大的是ND.产生H2的速率N>M
练习四:分析反应后质量的变化
将铁片放入下列溶液中,反应一段时间后,铁片的质量会增加 的是( ) A、稀H2SO4 B、FeSO4溶液 C、CuSO4溶液 D、稀HCl
浸入稀硫酸或稀盐酸中,铁被反应掉,铁片质量减少。
浸入FeSO4溶液中,铁不跟FeSO4反应,铁片质量不变。
浸入CuSO4溶液 中,铁被反应掉,但生成的铜会附着在铁片上。根据反应方程式可知: 反应掉的铁与生成的铜的质量比为56:64 ,所以反应掉的铁比生成的铜质量小,故一段时间后铁片的质量会增加。
Fe + CuSO4= FeSO4 + Cu
将两块锌片分别放入FeSO4溶液、CuSO4溶液中,反应一段时间后,分析锌片质量的变化情况。Zn:65 Fe:56 Cu:64
有A、B两块等质量的铁,将A浸入稀硫酸中,同时将B浸入硫酸铜溶液中,过一会儿,同时取出晾干,两块铁的质量mA、mB应该是( )A.mA<mB B.mA>mBC.mA=mB D.mA≥mB
为了测定某生铁中杂质的含量,取该生铁样品20克,放到盛有200克稀盐酸的烧杯中,反应后烧杯中物质总质量变成219.4克. ⑴生铁中的主要杂质是( ) ⑵计算该生铁中铁的质量分数是多少(Fe:56 H:1 )
解:根据质量守恒定律:M生铁+M稀盐酸=M烧杯中物质+M氢气
得:M氢气=20g + 200g - 219.4g = 0.6g
设20g生铁中铁的质量为x
答:生铁中铁的质量分数为84%
在CuCl2和FeCl2的混合溶液中,加入一定量的锌粉,充分反应后过滤,向滤渣中加入稀盐酸,有气体生成,则滤渣中一定有( )A.Cu、Fe、Zn B.Cu和FeC.Zn和Cu D.Zn、Fe
2、活泼金属先置换出最不活泼的金属:
活动性Zn>Fe>Cu
所以Zn先置换Cu;若置换完Cu后,Zn还有剩余,Zn再置换Fe
由题目可知:“滤渣”中仅仅有Cu,是不能和稀盐酸反应生成氢气的,所以至少要置换出Fe才行,如果把Fe全部置换出后Zn仍有剩余也行。
一工业废水中含有大量的硫酸亚铁、少量的硫酸铜及不溶性杂质,试设计一种经济简便的分离方案提取得到铜。并说明每一步的目的。
废水FeSO4CuSO4杂质
FeSO4CuSO4溶液
FeSO4溶液和剩余的硫酸
②将Cu全部置换出来。
④将过量的Fe粉全部反应掉。
填写下列表格(混合物栏中括号内为杂质)
1.被誉为“东方之冠”的中国馆是上海世博会标志性建筑之一,中国馆共向地下钻孔约5000根钢筋水泥桩,其横梁、椽子、斜撑、柱子的“中国红”外衣选用的是铝板,馆周围是大片红木色的塑木(塑料和木屑按照近似于1:1的比例制成)地板。(1)以上建筑中使用了金属材料的是 。 A.地下桩 B.地板 C.横梁外衣(2)钢和铝的共同点是 。 A.都是单质 B.都是合金 C.都能导电(3)铝能与NaOH溶液反应,化学方程式为:2Al+2NaOH+2H2O=2NaAlO2+3X, X的化学式为 。(4)将铝丝浸入硫酸铜溶液中能形成美丽的“铜树”,发生反应的化学方程式为
2Al+3CuSO4===Al2(SO4)3+3Cu
讨论:从以上实验,我们了解到金属钠的哪些物理和化学性质?
从煤油中取一小块金属钠,用小刀切去一端的外皮,观察实验现象.将金属钠放入水中,发现钠漂浮在水面上,并在水面四处“游走”发出“咝咝”的声音,片刻后熔成一个银白色小球。
物理性质:密度比煤油大,比水小; 硬度小;银白色,熔点低。化学性质:极易与氧气、水反应,且反应放出大量的热。
欲判断三种金属X、Y、Z的活动性顺序,没有必要验证的结论是( )A、Y能置换含X的化合物溶液中的X B、X能置换酸中的氢 C、Y能置换酸中的氢 D、Z不能置换酸中的氢
化学九年级下册课题 2 金属的化学性质教课ppt课件: 这是一份化学九年级下册<a href="/hx/tb_c9862_t3/?tag_id=26" target="_blank">课题 2 金属的化学性质教课ppt课件</a>,共11页。PPT课件主要包含了学习目标,重难点,引入新课,教学过程,讲授新课等内容,欢迎下载使用。
化学九年级下册课题 2 金属的化学性质教学ppt课件: 这是一份化学九年级下册课题 2 金属的化学性质教学ppt课件,共23页。PPT课件主要包含了温故知新,金属的化学性质,联系生活,金属与酸的反应,看图回答问题,火眼金睛,化合物,小试牛刀,能反应,难溶于水等内容,欢迎下载使用。
人教版九年级下册第八单元 金属和金属材料课题 2 金属的化学性质课文内容ppt课件: 这是一份人教版九年级下册第八单元 金属和金属材料课题 2 金属的化学性质课文内容ppt课件,文件包含人教九下第8单元课题2金属的化学性质第一课时pptx、人教九下第8单元课题2金属的化学性质第二课时pptx、稀盐酸与镁锌铁铜的反应mp4、金属与金属化合物溶液的反应mp4、铁丝在氧气中燃烧mp4、镁条燃烧mp4等6份课件配套教学资源,其中PPT共55页, 欢迎下载使用。













