






化学第五单元 化学方程式综合与测试复习ppt课件
展开一、 参加化学反应的各物质的质量总和,等于反应后生成的各物质的质量总和。
没有参加化学反应的物质不符合定律
不能漏掉任何一种反应物或生成物
因为化学反应前后原子的种类、数目和质量都没有变化。
是质量守恒不是体积守恒
判断下列说法是否正确:(1)100克干冰升华变成100克二氧化碳气体符合质量守恒定律(2)燃烧的镁带和生成的白色粉末质量相等。(3)3gC在10gO2中充分燃烧,生成13gC02。(4)2克氢气和8克氧气在点燃的条件下发生化合反应生成10克水
典型题三:根据质量守恒定律解释有关问题:
4、镁条在空气中燃烧后,生成物的质量比原来镁条的质量增加。 镁带在空气里燃烧,是 和 发生了___ 反应;根据质量守恒定律,反应后生成物的质量,一定等于参加反应的 和 的质量总和,所以生成物的质量比 重。
①铁丝燃烧后质量增加了。
根据质量守恒定律,参加反应的铁与氧气的质量总和等于生成的四氧化三铁的质量,所以铁丝燃烧后质量增加了。
②过氧化氢受热分解后,剩余液体的质量比原来反应物质量轻。 根据质量守恒定律,参加反应的过氧化氢的质量等于生成的水和氧气的质量总和,过氧化氢分解后氧气逸出,所以剩余液体的质量比原来反应物质量轻。
③点石能成金吗?水能变成汽油吗?为什么?
根据质量守恒定律,反应前后元素的种类不变,石头中没有金元素,所以点石不能成金。汽油中含碳元素,而水中不含碳元素,所以水不能变成汽油。
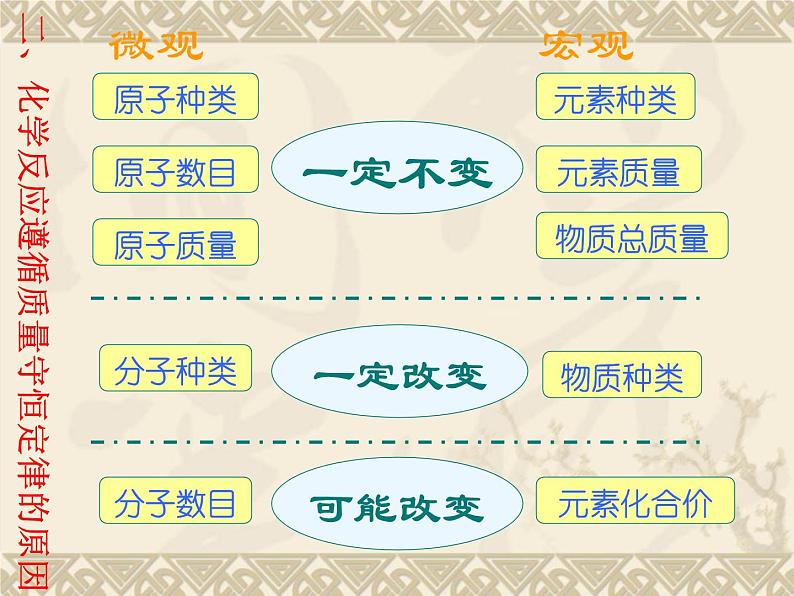
二、化学反应遵循质量守恒定律的原因
1.在化学反应前后,肯定没有变化的是( ) ①原子种类 ②分子数目 ③元素种类 ④物质总质量 ⑤物质种类 ⑥原子数目 A.①②③④ B.③④⑥ C.①③④⑥ D.①③④
2.高铁酸钾(K2FeO4)是一种高效多功能水处理剂,它与水反应不可能生成( ) A.氧气 B.碳酸钾 C.氢氧化钾 D.氢氧化铁
3.植物进行光合作用可简单表示为 H2O+CO2→淀粉+O2,由此判断:淀粉中一定含 有 元素,可能含有 元素。
1、下列现象不能用质量守恒定律解释的是——A、纸燃烧化为灰烬,灰烬的质量比纸的质量小B、镁条燃烧,生成物质量比镁条的质量大C、10克水受热变为10克水蒸气D、蜡烛燃烧后质量变小2、某物质在纯氧气中完全燃烧后生成了二氧化碳和水,则关于该物质的组成的说法正确的是——A、一定含有碳、氢、氧三种元素。 B、一定含有碳、氧元素。C 、一定含碳、氢元素。 D、无法确定3、某化合物X完全燃烧的化学方程式为 X+O2→CO2+H2O﹙未配平﹚则X不可能是——A、CO B、CH4 C、CH3OH D、C2H5OH
2、推断物质的组成与结构 例1、:某化合物X燃烧的化学方程式 X+3O2===2CO2+3H2O X的化学式:
C2H6O
例2:在2A+B2=2C的反应中,A的相对原子质量是24,B的相对原子质量是16,则C的相对原子质量是
因为是要比较反应前反应物的质量总和和反应后生成物的质量总和是否发生变化,所以,所有实验都必须设计在密闭的容器中完成,杜绝反应系统与环境之间有物质交换。
4、根据化学方程式不能获得的信息是——A、该反应中的反应物和生成物 B、各反应物和生成物的质量比C、发生反应所需要的条件 D、化学反应的快慢5、10克A和足量的B混合加热发生反应,10克A完全反应,生成8克C和4克D,则参加反应的A与B的质量比为——A、1:1 B、2:1 C、4:1 D、5:16、化学方程式3Fe + 2O2 点燃 Fe3O4可读作:__A.铁加氧气等于四氧化三铁 B.三个铁加两个氧气等于一个四氧化三铁C.铁和氧气点燃后生成四氧化三铁 D.铁加氧气点燃等于四氧化三铁
指出下列化学方程式的错误并改正
(1) Mg + O2 ↑ MgO2 4Fe + 3O2 2Fe2O3 2P2 + 2O5 2P2O5 KMnO4 K2MnO4 + MnO2 + O2 KClO3 KCl + O2 ↑(6) CuSO4 + NaOH Cu(OH)2 + Na2SO4
未配平,反应条件未注全
完成下列化学方程式1.电解水2.实验室用双氧水制氧气3.碳酸钙在高温条件下分解生成氧化钙和二氧化碳4.甲烷(CH4)燃烧后生成水和二氧化碳
2H2O 2H2↑ + O2↑ 2H2O2 2H2O +O2↑ CaCO3 CaO + CO2↑ CH4 +2O2 CO2 + 2H2O
根据化学方程式计算各物质的质量比
2H2O 2 H2 + O2
18×2 : 2×2 : 32
36: : 4 : 32
KClO3 KCl + O2
122.5×2 :74.5×2 :32×3
245 : 149 :96
【例题1】加热15.8g高锰酸钾,可以得到多少克氧气? ( 相对原子质量 : Mn 55 K 39 O 16 )
设加热分解15.8g高锰酸钾可以 得到 氧气的质量为x
2×158 32 15.8g x
解得 x = 1.6 g
答:加热分解15.8g高锰酸钾可以 得到1.6g氧气。
1、将氯酸钾和二氧化锰的固体混合物30.6克加热至质量不再改变为止,冷却后称量剩余固体物质的质量为21.0克。试问:(1)生成氧气的质量是多少克?(2)原混合物中氯酸钾和二氧化锰分别为多少克?
(K:39 Mn:55 O:16)
2.某赤铁矿样品120克,经测定含铁元素49.7克,求该赤铁矿样品中氧化铁的质量分数。(最后结果保留一位小数)
3.小强同学前往当地的石灰石矿区进行调查,他取回了若干快考试样品,对样品中的碳酸钙的质量分数进行检测,采用了以下的办法:取用8克这种石灰石样品,把40稀盐酸分四次加入,测量过程所得数据见下表(已知石灰石中含有的杂质不溶于水,不与盐酸反应)。
1)8g的石灰石样品中含有多少杂质?(2)样品中碳酸钙的质量分数是多少?(3)上表中m的数值应为多少?(4)要得到280kg的氧化钙,需要含碳酸钙质量分数为80%的石灰石多少kg?
(1)实验室制取氧气加热高锰酸钾制取氧气: 2KMnO4═K2MnO4+MnO2+O2↑ 加热氯酸钾制取氧气: 2KClO3 ═ 2KCl+3O2 ↑ 过氧化氢分解制取氧气: 2H2O2 ═ 2H2O+O2 ↑ (2)实验室制取二氧化碳 (提示:制取方法:碳酸钙与盐酸混合反应) CaCO3+2HCl═CaCl2+H2O+CO2 ↑
H2O H2 + O2
1、配平下列化学方程式1、﹙﹚H2O=﹙﹚H2↑+﹙﹚O2↑ 2、 ﹙ ﹚AI + ﹙ ﹚ O2= ﹙ ﹚ AI2O3 3、( )Fe2O3+( )C = ( )Fe+ ( )CO2↑ 4、﹙ ﹚KCIO3=﹙ ﹚KCI+﹙ ﹚O2↑2.下列各式中,正确表示铝与稀硫酸反应的化学方程式是A.Al + H2SO4 ==== AlSO4 + H2↑ B.2Al+ 3H2SO4 ==== Al2(SO4)3 + 3H2↑C. Al + 2H2SO4 ==== Al(SO4)2 + 2H2↑ D. 2Al + H2SO4 ==== Al2SO4 + H2↑
3.在2A+B == 2C反应中,已知A的相对分子质量为24,C的相对分子质量为40,则B的相对分子质量为A. 16 g B. 32 g C. 16 D. 32 4.在 2H2O2 MnO2 2H2O+O2↑ 的反应中,反应前后肯定发生变化的是A.元素种类 B.各种原子的数目C.各元素的化合价 D.物质的质量总和5.铝在氧气中燃烧生成氧化铝。在这个反应中,铝、氧气、氧化铝的质量比是 A. 27∶32∶102 B. 27∶24∶43 C. 4∶3∶2 D. 108∶96∶204
1、近几年来,科学发现在生物体内存在少量一氧化氮,它有扩张血管和增强记忆力的功能,成为当前生物科学研究的热点。一氧化氮是工业制取硝酸的中间产物,生成一氧化氮的化学方程式为: 4NH3 + 5O2 催化剂 4NO + 6X ,则X的化学式是 。2、 我国自行设计和制造的长征3号火箭用液氧和液氢作推进剂,点火时发生反应的化学方程式 3、饲养观赏鱼,可以陶冶人的情操,增进人们对生活的热爱。空运观赏鱼,必须密封。为了解决鱼的吸氧问题,可在水中加入过氧化钙(化学式CaO2),过氧化钙与水反应生成的是氢氧化钙和氧气。写出过氧化钙与水反应的化学方程式
2H2+O2点燃2H2O
2CaO2+2H2O=2Ca﹙OH﹚2+02↑
4、在反应A+B==C+D中,5gA和10gB恰好完全反应,生成8gC;若2.5gA和足量的B反应,可生成D的质量是 。5、实验室用锌跟足量的稀盐酸(HCl)反应,可以制得氯化锌和氢气。如果用32.5g的锌可制得氢气多少克?﹙Zn:65 、 H:1﹚
植物的光合作用可表示为:
产生的淀粉中一定含有的元素是( )。
【例2】 在反应2A+5B=2C+4D中,C、D的相对分子质量之比为9:22。若2.6 gA与B完全反应后,生成8.8 gD。则在此反应中,B与D的质量比为 ( ) A.4:9 B.8:11 C.10:11 D.31:44
【例3】某有机物R在足量氧气中完全燃烧后的化学方程式如下:2R + 13O2 8CO2 +10H2O。 根据质量守定律,R的化学式为 ( )A.C4H10 B.CH4C.CH20 D.C2H4O2
【例9】纯净的锌片6.5 g恰好和93.7 g稀盐酸完全反应,求反应后所得溶液中溶质质量分数。
例2:有一种含水的过氧化氢样品10g,在二氧化锰的催化作用下,完全分解得到氧气3.2g。 求:生成水的质量?
典型题二:能用质量守恒定律判断物质的元素组成及推断物质的化学式:
2、动物脂肪通过呼吸作用生成二氧化碳和水,反应产生的热量是维持生命活动的能量。则动物脂肪中( )A.一定含有碳、氢、氧元素B.一定含有碳、氢元素,可能含有氧元素C.一定含有二氧化碳和水D.一定含有碳、氢元素,一定不含氧元素3、已知化学反应A2+3B2=2C,则C的化学式为____________(用A、B表示)。
典型题四:正确书写化学方程式
7、“珍爱生命,拒绝烧烤”。露天烧烤不仅产生大量有害气体污染环境,而且烧焦的肉类中还含有强烈的致癌物质3,4—苯并芘,其化学式为C20H12,该物质在空气中燃烧,可生成二氧化碳和水,试写出这一反应的化学方程式:
C20H12+23O2 = 20CO2+6H2O
6.下列现象不能用质量守恒定律解释的是( )。 (A)纸燃烧化为灰烬,灰烬的质量比纸的质量小 (B)镁条燃烧,生成物的质量比镁条的质量大 (C)浓硫酸敞口放置一段时间后质量增大 (D)蜡烛燃烧后质量减小
11.2008年北京奥运会使用的“祥云”火炬,内装燃料是液态丙烷。常温下,丙烷气体通过 的方法变为液态,灌装在火炬内。丙烷燃烧的化学方程式为C3H8+xO2===yCO2+zH2O,则x值为 。
13.在化学反应A + 2B=3C + D中,6克A与8克B恰好完全反应,生成9克D.若反应生成15克C,则参加反应的B的质量为( )A.8g B.24g C.12g D.16g
18.在一个密闭容器内有X、 Y 、Z、 Q四种物质,在一定条件下充分反应,测得反应前后物质质量如下:
处理数据后得出的结论正确的是( )A .反应类型为分解反应 B.反应类型为化合反应C.生成Z为16g D.反应物为X、Y
分析:前后质量比较 不变 +10 -4 -6
21.二氧化碳是常用的灭火剂,但金属镁着火不能用二氧化碳扑救,因为镁可以在二化碳中继续燃烧,生成氧化镁和碳单质.试写出在二化碳气阀可燃烧的化学方程式.22.配平化学方程式 C2H2 + O2 ═ CO2+ H2O FeS2+ O2 ═ Fe2O3 + SO2
2Mg+CO2═2MgO+C
27.金属材料在生产、生活中有着广泛的应用。(1)人类每年从自然界提取大量的金属,其中提取量最大的是铁。用赤铁矿(主要成分为Fe2O3)和一氧化碳炼铁的化学方程式为 。28.锅炉发生爆炸,可能是由于锅炉内水垢过厚或缺水造成的。为了防止锅炉爆炸,常采用下列措施:(3)定期清洗锅炉。水垢的主要成分是碳酸钙,写出用稀盐酸清洗水垢的化学方程式: 。29.如图为自然界中碳循环示意图。 (1)海洋能够吸收二氧化碳,其原因之一是二氧化碳可以跟水反应,请写出该反应的化学方程式: 。
CaCO3+2HCl═ CaCl2+H2O+CO2↑
CO2+H2O═H2CO3
30.高级轿车上装有安全气囊,内部储有硝酸铵( )。当汽车高速行驶中受到猛烈撞击时硝酸铵迅速分解,产生大量的氧气、氮气和水,充满气袋,填补在司机与挡风玻璃、方向盘之间,防止司机受伤。请写出硝酸铵受到猛烈撞击后发生的化学反应方程式: 2NH4NO3 ═ O2↑+2N2 ↑ +4H2O 该反应类型是 。
33、某同学把3克碳放在不同质量的氧气中充分燃烧,实验数据如下:(1)以上数据说明,这三次实验中第 次恰好完全反应。(2)第 次实验碳有剩余,剩余 克。(3)第 次实验氧气有剩余,剩余 克。(4)在这三次实验的化学反应过程中,哪几次符合质量守恒定律 。
34、某中学科学小组为了探究一种未知物质M的组成。进行有关探究,在密闭容器中装入物质M、氧气、二氧化碳、水蒸气,在一定的条件下,测得反应前后的质量如下:(1)认为x的值为 。(2)如在此过程中生成22克二氧化碳,则同时生成水的质量为 。(3)未知物质M一定含有的元素有 。
分析前后质量变化:-96 +88 +54 -46
36.石灰石是一种重要的建筑材料,某学校研究性学习小组为了测定某地矿山石灰石碳酸钙的质量分数,取来了一些石灰石样品,并取稀盐酸200克平均分成4份进行实验,结果如下:(1)哪几次反应中石灰石有剩余? (2)表中m的数值是 。(3)试计算这种石灰石矿中碳酸钙的质量分数?(4)试计算稀盐酸中溶质的质量分数?
4、某物质6克在空气中充分燃烧生成二氧化碳4.4克,水2.7克,则该物质中 ( ) A 一定有C、H、O B 只有C、H C 一定有C、H,可能有O D无法判断5、某物质在空气中充分燃烧生成二氧化碳4.4克,水2.7克,则该物质可能是( )A.CH2O B.CH4 C.C2H60 D.C2H4O2
20.某3g化合物完全燃烧,生成8.8gCO2和5.4gH2O,则该化合物中( ) A.含有C、H、O三种元素 B.只含有C、H两种元素 C.只含有C、O两种元素 D.无法确定
15.蜡烛燃烧前质量是ag,燃烧后质量为bg,生成的二氧化碳质量为cg,水蒸气的质量为dg, 则产物共 g, 参加反应的氧气的质量为 g。
14.在锥形瓶内将30g过氧化氢溶液与2g二氧化锰混合,完全反应后,瓶内剩余物质的总质量为27g,则生成氧气的质量是 g。
19.有一种有机物23g在空气中完全燃烧后共生成44g二氧化碳和27g水,该有机物含碳元素的质量是 g,含氢元素的质量是 g,它是由 元素组成的。
如图所示是测定蜡烛燃烧时的质量变化装置,天平是物理天平,左托盘上蜡烛的上方罩着吸收器。如果实验时,蜡烛正常燃烧,生成的气体顺利通过吸收器,吸收器的药品只在3min内起吸收作用。试回答:(1)本实验中,蜡烛燃烧时,反应物是 ,生成物是 ,反应条件是 。(2)3min内,天平是否保持平衡? ,原因是(3)3min后,会出现什么结果? ,原因是是否符合质量守恒定律? 。
生成物中增加了氧元素,并且被吸收器吸收,左盘内物质质量增加。
3min后,吸收器的药物不能再吸收生成物,二氧化碳和水蒸气会逸散
点燃(1)2Mg+O2===2MgO 点燃(2)S+O2 ====SO2 点燃(3)C+O2====CO2 点燃(4)2C+O2=====2CO 高温(5)CO2+C=====2CO 点燃(6)4P+5O2====2P2O5
点燃(7)3Fe+2O2=====Fe3O4 点燃(8)2H2+O2====2H2O 点燃(9)2CO+O2=====2CO2(10)CO2+H2O==H2CO3
(11) Al+ O2 Al2O3
MnO22KClO3=====2KCl+3O2↑ △ △2KMnO4===K2MnO4+MnO2+O2↑ MnO22H2O2====2H2O+O2↑ 通电2H2O====2H2↑+O2↑ H2CO3===H2O+CO2↑
Zn+H2SO4==ZnSO4+H2↑Mg+H2SO4==MgSO4+H2↑Fe+H2SO4 ==FeSO4+H2↑2Al+3H2SO4 ==Al2(SO4)3+3H2↑Zn+2HCl==ZnCl2+H2↑Mg+2HCl==MgCl2+H2↑Fe+2HCl==FeCl2+H2↑2Al+6HCl==2AlCl3+3H2 高温C+2CuO=====2Cu+CO2↑Fe+CuSO4==FeSO4+CuCuSO4+Zn==ZnSO4+CuHg(NO3)2+Cu==Cu(NO3)2+Hg
初中化学人教版九年级上册课题 3 利用化学方程式的简单计算试讲课课件ppt: 这是一份初中化学人教版九年级上册课题 3 利用化学方程式的简单计算试讲课课件ppt,共27页。PPT课件主要包含了常规型,×158,变式题,单位转换型,小试牛刀,5kg,125g,二氧化锰05g,剩余质量337g,图表型等内容,欢迎下载使用。
初中化学人教版九年级上册第五单元 化学方程式课题 3 利用化学方程式的简单计算精品ppt课件: 这是一份初中化学人教版九年级上册第五单元 化学方程式课题 3 利用化学方程式的简单计算精品ppt课件,共29页。PPT课件主要包含了x32kg,y160kg,z800kg,设未知量,列比例式求解,简明地写出答案,×2×16,×158,x≈06g,一设二写三关四列五答等内容,欢迎下载使用。
初中化学人教版九年级上册课题 2 如何正确书写化学方程式精品ppt课件: 这是一份初中化学人教版九年级上册课题 2 如何正确书写化学方程式精品ppt课件,共33页。PPT课件主要包含了化学方程式的书写方法,化学方程式的书写步骤,化学方程式的书写口诀,小试牛刀,奇偶配平法,化学方程式配平方法,待定系数法,最小公倍数法,令1法,典例1等内容,欢迎下载使用。













