

高中人教版 (2019)第一节 铁及其化合物优秀第1课时导学案
展开第一节 铁及其化合物
第1课时 铁的单质
1.金属的物理通性
金属的物理性质既有相似性又有差异性,如金属的特殊性有:
(1)金、铜等少数金属有特殊颜色。
(2)除汞外,常温下金属都是固体。
(3)密度相差较大。其中常温下密度最小的金属是锂(0.535 g·cm-3),常见金属中密度最大的是铂(21.45 g·cm-3)。
(4)硬度相差很大。金属中硬度最大的是铬(Cr),钠、钾等金属硬度较小。
(5)熔、沸点相差也很大。钠、钾的熔点都低于水的沸点(100 ℃),而钨的熔点高达3 422 ℃。
2.铁的存在和冶炼
(1)铁的存在
铁在自然界中可以像陨铁中的铁那样以单质形态存在,但主要是以+2价和+3价化合物的形态存在于矿石中。铁元素在地壳中的含量仅次于氧、硅和铝,居第四位。
(2)铁的冶炼
我国目前发现最早的人工冶铁制品是甘肃灵台出土的春秋初年秦国的铜柄铁剑,这说明春秋初年我国已掌握了冶铁技术。战国中期以后,铁制工具在社会生产中发挥了巨大的作用。工业炼铁的原理是用还原的方法把铁从铁矿石中提炼出来。工业炼铁的反应原理为3CO+Fe2O3eq \(=====,\s\up7(高温))2Fe+3CO2。
3.铁的化学性质(能写离子方程式的写离子方程式)
eq \a\vs4\al()
Fe与足量的Cl2、KMnO4(H+)、硝酸溶液等强氧化剂反应时,被氧化为+3价;Fe与足量的S、I2、Cu2+等弱氧化剂反应时,被氧化为+2价。
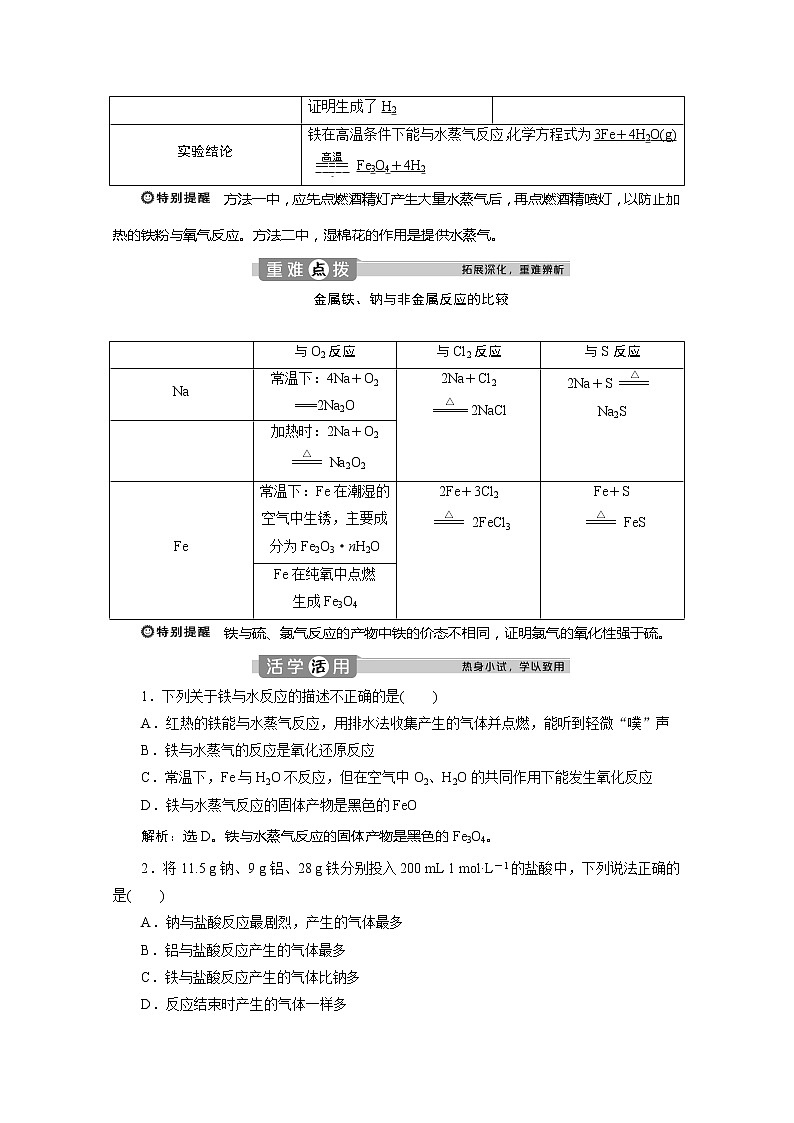
4.铁与水蒸气反应的实验探究
(1)铁与冷水或热水不反应,但在空气中氧气、二氧化碳、水蒸气的作用下,易腐蚀。
(2)铁与水蒸气反应的实验探究
续 表
方法一中,应先点燃酒精灯产生大量水蒸气后,再点燃酒精喷灯,以防止加热的铁粉与氧气反应。方法二中,湿棉花的作用是提供水蒸气。
金属铁、钠与非金属反应的比较
铁与硫、氯气反应的产物中铁的价态不相同,证明氯气的氧化性强于硫。
1.下列关于铁与水反应的描述不正确的是( )
A.红热的铁能与水蒸气反应,用排水法收集产生的气体并点燃,能听到轻微“噗”声
B.铁与水蒸气的反应是氧化还原反应
C.常温下,Fe与H2O不反应,但在空气中O2、H2O的共同作用下能发生氧化反应
D.铁与水蒸气反应的固体产物是黑色的FeO
解析:选D。铁与水蒸气反应的固体产物是黑色的Fe3O4。
2.将11.5 g钠、9 g铝、28 g铁分别投入200 mL 1 ml·L-1的盐酸中,下列说法正确的是( )
A.钠与盐酸反应最剧烈,产生的气体最多
B.铝与盐酸反应产生的气体最多
C.铁与盐酸反应产生的气体比钠多
D.反应结束时产生的气体一样多
解析:选A。经计算知金属相对于盐酸都是过量的,所以Al、Fe剩余,而剩余的Na又能与水反应,因而钠与盐酸反应产生的气体最多。
3.(2019·教材改编题)某化学兴趣小组利用如图装置进行“铁与水反应”的实验,并检验产物的性质,请回答下列问题:
(1)A装置的作用是___________________________________________________,
B装置中反应的化学方程式为_____________________________________________。
(2)D装置的作用是_____________________________________________________
________________________________________________________________________。
(3)E装置中的现象是________________________________________________________。
(4)A、B两个装置中应先点燃________处的酒精(喷)灯,点燃E处酒精灯之前应进行的操作是________________________________________________________________________
________________________。
解析:(1)B装置中发生的反应是3Fe+4H2O(g)eq \(=====,\s\up7(高温))Fe3O4+4H2,故A装置的作用是产生水蒸气。(2)D装置的作用是除去未反应的水蒸气,干燥H2。(3)E装置中发生的反应为H2+CuOeq \(=====,\s\up7(△))Cu+H2O,故E装置中的现象为黑色固体变为红色,同时硬质玻璃管右端管壁有水珠生成。(4)应先点燃A处酒精灯,若先点燃B处酒精喷灯,B装置中的Fe会与空气中的O2反应;点燃E处酒精灯之前要收集H2,并检验其纯度。
答案:(1)产生水蒸气 3Fe+4H2O(g)eq \(=====,\s\up7(高温))Fe3O4+4H2
(2)除去未反应的水蒸气,干燥H2
(3)黑色固体变为红色,硬质玻璃管右端管壁有水珠生成
(4)A 收集H2,并检验其纯度
合格考训练
1.在给定条件下,下列物质间的转化不能实现的是( )
A.Feeq \(――→,\s\up7(Cl2),\s\d5(加热))FeCl3B.Feeq \(――→,\s\up7(盐酸),\s\d5(常温))FeCl3
C.Feeq \(――→,\s\up7(H2O(g)),\s\d5(高温))Fe3O4D.Feeq \(――→,\s\up7(S),\s\d5(加热))FeS
解析:选B。Fe与非氧化性酸反应被氧化为+2价,B错。
2.(2019·教材改编题)下列物质中,在一定条件下与铁反应,且铁元素的化合价能变为+3价的是( )
A.稀硫酸B.氯气
C.硫酸铜溶液D.稀盐酸
解析:选B。Fe与强氧化剂Cl2反应被氧化为+3价。
3.下列反应中,能置换出铁的是( )
A.Cu和FeSO4(溶液)B.Na和FeSO4(溶液)
C.C和Fe2O3(高温)D.Ag和FeSO4(溶液)
解析:选C。A项不发生反应;B项钠先与水反应生成氢氧化钠和氢气,氢氧化钠再与硫酸亚铁反应产生氢氧化亚铁沉淀;C项反应为3C+2Fe2O3eq \(=====,\s\up7(高温))3CO2+4Fe;D项不发生反应。
4.(2019·教材改编题)下列变化通过一步反应不能直接完成的是( )
A.Fe―→Fe3O4B.Na―→Na2CO3
C.Na2O2―→NaOHD.Na―→Na2O2
解析:选B。A项反应为3Fe+4H2O(g)eq \(=====,\s\up7(高温))Fe3O4+4H2;B项Na性质活泼,但不能通过一步反应直接转化为Na2CO3;C项反应为2Na2O2+2H2O===4NaOH+O2↑;D项反应为2Na+O2eq \(=====,\s\up7(△))Na2O2。
5.有A、B、C三种常见的金属单质,A在空气中燃烧生成淡黄色固体;B也能在空气中剧烈燃烧,发出耀眼的白光;C在一定条件下与水蒸气反应生成H2和一种黑色固体。根据以上信息回答下列问题:
(1)写出化学式:A________;B________;C________。
(2)写出化学方程式:
①A在空气中燃烧_______________________________________________________;
②C与水蒸气反应________________________________________________________;
③A与水反应___________________________________________________________。
解析:淡黄色固体是过氧化钠,故A是钠;B能在空气中剧烈燃烧,发出耀眼的白光,故B是镁;C在一定条件下与水蒸气反应生成 H2和一种黑色固体,故C是铁。
答案:(1)Na Mg Fe
(2)①2Na+O2eq \(=====,\s\up7(△))Na2O2
②3Fe+4H2O(g)eq \(=====,\s\up7(高温))Fe3O4+4H2
③2Na+2H2O===2NaOH+H2
等级性测试
1.关于铁丝在氧气中燃烧、铁丝生锈的说法正确的是( )
A.铁丝燃烧产生白烟
B.铁丝生锈是缓慢氧化
C.铁丝燃烧的产物是Fe2O3
D.铁锈的主要成分是Fe3O4
解析:选B。铁丝燃烧看不到白烟,会看到火星四射,A错误;铁丝生锈是缓慢氧化,是铁和空气中的氧气缓慢的发生反应,B正确;铁丝燃烧的产物是Fe3O4,C错误;铁锈的主要成分是Fe2O3,D错误。
2.能正确表示下列反应的离子方程式的是( )
A.钠与氢氧化钠溶液反应:2Na+2H2O===2Na++2OH-+H2
B.铁与CuSO4溶液反应:Fe+Cu2+===Cu+Fe3+
C.钠与盐酸反应:Na+2H+===Na++H2
D.铁与稀硫酸反应:2Fe+6H+===2Fe3++3H2
解析:选A。B中Fe与Cu2+反应时,Cu2+氧化性较弱,只能把Fe氧化为Fe2+,正确的离子方程式应为Fe+Cu2+===Fe2++Cu。C中电荷不守恒。D中铁与稀硫酸反应生成Fe2+而不是Fe3+。
3.类比是研究物质性质的常用方法之一,可预测许多物质的性质。下列类比推测的说法中正确的是( )
A.已知Fe与O2能直接化合生成Fe3O4,推测Cu与O2可直接化合生成Cu3O4
B.已知Na与H2O反应生成 NaOH和H2,推测Fe与H2O反应生成Fe(OH)2和H2
C.已知Fe能与CuSO4溶液反应,推测Fe与AgNO3溶液也能反应
D.已知Na在常温下能与H2O反应,推测Fe在常温下也能与H2O反应
解析:选C。Fe与O2在点燃的条件下反应生成Fe3O4,Cu与O2反应生成CuO,故A错误;Fe与水蒸气反应生成Fe3O4和H2,故B错误;Fe是活泼金属,能把金属活动性顺序中位于其后的金属离子从其盐溶液中置换出来,故C正确;Na在常温下能与H2O反应,但是Fe与水在常温下不反应,故D错误。
4.铁粉在高温条件下可与水蒸气反应,若反应后得到的干燥固体质量比反应前铁粉的质量增加了32 g,则参加反应的铁粉的物质的量是( )
A.0.5 ml B.1 ml
C.1.5 mlD.2 ml
解析:选C。
3Fe+4H2O(g)eq \(=====,\s\up7(高温))Fe3O4+4H2 Δm(固体)
3 ml 64 g
n(Fe) 32 g
解得n(Fe)=1.5 ml。
5.下列说法不正确的是( )
A.铁与纯氧气和水蒸气反应都能生成四氧化三铁
B.铁在高温下与水蒸气的反应是置换反应
C.铁在盐酸反应生成氯化铁和氢气
D.铁与盐酸或水蒸气反应,都做还原剂
解析:选C。铁能在纯氧气中燃烧,也能在高温下与水蒸气反应,二者共同产物为四氧化三铁;铁与盐酸和水蒸气发生的反应都是置换反应,在反应中铁的化合价升高,铁做还原剂;铁与盐酸反应生成氯化亚铁,而不是氯化铁。
6.已知钠、铁都能与水反应,下列叙述不正确的是( )
A.它们反应的难易程度不同
B.它们反应的产物不完全相同
C.都需在高温条件下进行
D.反应类型都是置换反应
解析:选C。钠、铁都能与水发生置换反应,但二者反应难易程度不同,其产物不完全相同。钠在常温下与冷水剧烈反应,生成氢氧化钠和氢气;铁在高温下与水蒸气反应,生成四氧化三铁和氢气。
7.下列离子方程式不正确的是( )
A.Na与H2O反应:2Na+2H2O===2Na++2OH-+H2
B.Al与稀盐酸反应:2Al+6H+===2Al3++3H2
C.Fe与稀盐酸反应:2Fe+6H+===2Fe3++3H2
D.Al与CuCl2溶液反应:2Al+3Cu2+===2Al3++3Cu
解析:选C。Fe与稀盐酸反应的离子方程式为Fe+2H+===Fe2++H2。
8.在标准状况下,将5.6 g铁和4.6 g钠分别与100 mL 1 ml·L-1的盐酸反应,则放出H2的体积( )
A.铁的大 B.钠的大
C.铁和钠放出的一样大D.无法比较
解析:选B。n(HCl)=1 ml·L-1×0.1 L=0.1 ml,n(Fe)=eq \f(5.6 g,56 g·ml-1)=0.1 ml,Fe与盐酸反应的化学方程式为Fe+2HCl===FeCl2+H2↑,反应中Fe过量,以HCl计算产生H2的物质的量为0.05 ml;n(Na)=eq \f(4.6 g,23 g·ml-1)=0.2 ml,Na与HCl反应的化学方程式为2Na+2HCl===2NaCl+H2↑,反应中Na过量,过量的Na继续与水发生反应2Na+2H2O===2NaOH+H2↑,Na无论是与HCl反应还是与H2O反应,都存在关系:2Na~H2,生成H2的物质的量为0.1 ml;所以标准状况下Na反应放出H2的体积大。
9.如下图所示,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热并通入水蒸气,可完成高温下Fe与水蒸气反应的实验。
回答下列问题:
(1)写出有关反应的化学方程式:________________________________________________。
(2)干燥管C中盛放的药品是________,作用是___________________________________。
(3)在D处画出用简单方法(用试管)收集氢气的装置图(所需其他仪器自选)。
(4)圆底烧瓶中盛装的是水,该装置的主要作用是________________;圆底烧瓶底部放入几片碎瓷片,碎瓷片的作用是_____________________________________________________。
(5)实验开始时应先点燃________,理由是_____________________________________
________________________________________________________________________。
解析:(1)书写化学方程式时,应注意H2O的状态与产物的成分。(2)应选固体干燥剂。(3)应采用向下排空气法收集,注意导管伸入的位置。(4)通过加热圆底烧瓶中的水获得水蒸气。(5)实验时,应先加热圆底烧瓶,产生的水蒸气排净装置中的空气后,再加热硬质玻璃管,防止铁粉被空气中的氧气氧化。
答案:(1)3Fe+4H2O(g)eq \(=====,\s\up7(高温))Fe3O4+4H2
(2)碱石灰(或无水CaCl2等) 除去H2中的水蒸气
(3)如图所示(注意用向下排空气法,导管伸入试管底部)
(4)为反应提供持续不断的水蒸气 防止液体暴沸
(5)酒精灯 先点燃酒精灯,产生的水蒸气排净装置中的空气后,再点燃酒精喷灯,防止Fe与O2反应
10.现有2 ml·L-1的盐酸和硫酸各100 mL,分别加入等质量的铁粉,反应完全后,所产生的气体质量之比为2∶3。试求加入的铁粉的质量。
答案:根据化学方程式Fe+2HCl===FeCl2+H2↑和Fe+H2SO4===FeSO4+H2↑可知,
若盐酸、硫酸过量,等量的铁全部反应,则产生H2的质量比应为1∶1;
若铁都过量,则两酸都全部反应,根据题给数据,n(HCl)=n(H2SO4)=2 ml·L-1×0.1 L=0.2 ml,则盐酸产生H2 0.1 ml,硫酸产生H2 0.2 ml,二者的质量比为1∶2。
这两种情况不符合题意,则只能是盐酸中铁过量(盐酸耗铁少),硫酸中铁不足(硫酸耗铁多),这种情况下,才可能使产生的H2的质量比为2∶3。
当铁与盐酸反应,盐酸全部反应时,产生的H2为0.1 ml,根据产生H2的质量比为2∶3可知,硫酸产生H2 0.15 ml。
设硫酸中参加反应的铁的质量为x,则
Fe+H2SO4===FeSO4+H2↑
56 g 1 ml
x 0.15 ml
x=8.4 g
答:加入的铁粉的质量为8.4 g。
11.在一定条件下用普通铁粉和水蒸气反应,可以得到铁的氧化物。该氧化物又可以经过此反应的逆反应,生成颗粒很细的铁粉。这种铁粉具有很高的反应活性,在空气中受撞击或受热时会燃烧,所以俗称“引火铁”。请分别用如图所示的两套装置,制取上述铁的氧化物和“引火铁”。实验中必须使用普通铁粉和稀盐酸,其他试剂自选(装置中必要的铁架台、铁夹、铁圈、石棉网、加热设备等在图中均已略去)。回答下列问题:
(1)实验进行时试管A中应加入的试剂是________,烧瓶B的作用是__________,烧瓶C的作用是________,在试管D中收集得到的是________。
(2)实验时,U形管中应加入的试剂是________,长颈漏斗H中应加入________。
(3)两套装置中,在实验时需要加热的仪器是(填该仪器对应的字母)________。
(4)试管E中发生反应的化学方程式是______________________________________。
(5)为了安全,在E管中反应发生前,在F出口处必须____________________;E管中反应开始后,在F出口处应________。
解析:根据题意可知,该题中发生了三个化学反应:
3Fe+4H2O(g)eq \(=====,\s\up7(高温))Fe3O4+4H2;
Fe3O4+4H2eq \(=====,\s\up7(高温))3Fe+4H2O;
Zn+2HCl===ZnCl2+H2[用稀盐酸和较活泼的金属(通常用Zn)制取H2]。
在题中给出的两个装置中,甲为水蒸气和铁反应的装置,因为D为集气装置,无氢气发生装置。因乙中有氢气制取装置I,故乙为H2还原Fe3O4的装置,用于制取“引火铁”。判断出这两个装置的用途后再进行解答。
(1)由于甲是Fe的氧化装置,故A中装有普通铁粉;B是产生水蒸气的装置;C的作用是安全瓶,防止水槽内水倒吸;试管D中收集的气体是H2。
(2)U形管的作用是净化、干燥氢气,应用固体NaOH或碱石灰等固体干燥剂。因制取过程中,H2中混有少量的HCl气体和水蒸气,在干燥H2的过程中一并去除HCl气体。
(3)需要加热的仪器:A(Fe与水蒸气需在高温下反应)、B(需加热制取水蒸气)、E(H2还原Fe3O4时需加热)。
(4)试管E中发生H2还原Fe3O4的反应:Fe3O4+4H2eq \(=====,\s\up7(高温))3Fe+4H2O。
(5)因为H2和O2混合点燃或加热时可能爆炸,所以H2在使用时要检验纯度,多余的氢气要燃烧掉或导出室外,以避免与室内空气混合爆炸。
答案:(1)普通铁粉 产生水蒸气 防止倒吸 氢气
(2)碱石灰(或固体NaOH、CaO等碱性干燥剂) 稀盐酸
(3)ABE
(4)Fe3O4+4H2eq \(=====,\s\up7(高温))3Fe+4H2O
(5)检验氢气的纯度 点燃氢气
课程标准
核心素养
1.了解铁与某些非金属单质、酸和盐溶液的反应。
2.通过实验探究了解铁与水蒸气的反应。
1.变化观念:知道铁作为还原剂与某些非金属单质、酸和盐溶液反应时,铁与氧化性较弱的氧化剂反应,铁原子生成+2价铁的化合物;铁与氧化性较强的氧化剂反应时,铁原子生成+3价铁的化合物。
2.科学探究:通过对铁与水蒸气反应实验原理的探究,分析可能的生成物。
状态
颜色
延展性
导电、导热性
绝大多
数为固态
不透明、有金属光
泽,大多是银白色
大多数
较好
良好
方法
方法一(实验改进)
方法二
实验装置
方法
方法一(实验改进)
方法二
气体检验
用小试管C收集一试管气体,点燃,听到轻微的“噗”声,证明生成了H2
用火柴点燃肥皂泡,听到爆鸣声,证明生成了H2
实验结论
铁在高温条件下能与水蒸气反应,化学方程式为3Fe+4H2O(g)eq \(=====,\s\up7(高温))Fe3O4+4H2
与O2反应
与Cl2反应
与S反应
Na
常温下:4Na+O2
===2Na2O
2Na+Cl2
eq \(=====,\s\up7(△))2NaCl
2Na+Seq \(=====,\s\up7(△))
Na2S
加热时:2Na+O2
eq \(=====,\s\up7(△))Na2O2
Fe
常温下:Fe在潮湿的
空气中生锈,主要成
分为Fe2O3·nH2O
2Fe+3Cl2
eq \(=====,\s\up7(△))2FeCl3
Fe+S
eq \(=====,\s\up7(△))FeS
Fe在纯氧中点燃
生成Fe3O4
课堂小结
铁eq \b\lc\{(\a\vs4\al\c1(与非金属反应\b\lc\{(\a\vs4\al\c1(与足量的Cl2等强氧化剂反应被氧化为+3价,与足量的S、I2等弱氧化剂反应被氧化为+2价)),与非氧化性酸反应(如稀硫酸、盐酸)被氧化为+2价,与盐溶液反应,如Fe+Cu2+===Fe2++Cu,在高温下与水蒸气反应:3Fe+4H2O(g)\(=====,\s\up7(高温))Fe3O4+4H2))
人教版 (2019)必修 第一册第二节 金属材料第1课时导学案及答案: 这是一份人教版 (2019)必修 第一册第二节 金属材料第1课时导学案及答案,共11页。
高中化学第一节 铁及其化合物优质第2课时2课时学案及答案: 这是一份高中化学第一节 铁及其化合物优质第2课时2课时学案及答案,共15页。学案主要包含了铁的氧化物,铁的氢氧化物等内容,欢迎下载使用。
高中化学人教版 (2019)必修 第一册第一节 钠及其化合物优秀第1课时学案: 这是一份高中化学人教版 (2019)必修 第一册第一节 钠及其化合物优秀第1课时学案,共9页。学案主要包含了g,溶质质量分数为eq等内容,欢迎下载使用。













