
高中化学人教版 (2019)必修 第二册第一节 硫及其化合物第1课时教学设计
展开5.1 硫及其化合物
第1课时 硫与二氧化硫
教学设计
教学目标
知识与技能
了解二氧化硫的物理性质、二氧化硫与水的反应、还原性和漂白性。
2. 过程与方法
(1)通过实际应用、实验探究、理论分析、归纳提升来学习二氧化硫的溶解性、还原性、漂白性等。
(2)体验科学探究的过程和科学思维方法,提高分析、解决问题的能力。
3.情感态度与价值观
认识二氧化硫在生产生活中的应用和对生态环境、食品安全的影响, 培养学生辩证地分析事物的科学态
度和价值观。
二、教学重难点
教学重点
二氧化硫与水反应、二氧化硫的漂白性。
2.教学难点
二氧化硫的漂白原理。
三、教学过程
四.板书设计
硫及其化合物
(一)硫
(二)二氧化硫
1、物理性质
2、化学性质
(1)SO2具有酸性氧化物的性质
(2)漂白性
(3)还原性和氧化性
教学环节
教学内容
设计意图
1.新课导入
【PPT】播放当天的空气质量日报
【师】在不少地区将雾和霾一起作为灾害性天气现象进行预警预报,统称为“雾霾天气”。雾气看似温和,里面却含有各种对人体有害的细颗粒、有毒物质达20多种,包括了酸、碱、盐、胺、酚等,以及尘埃、花粉、螨虫、流感病毒、结核杆菌、肺炎球菌等,其含量是普通大气水滴的几十倍。与雾相比,霾对人的身体健康的危害更大。由于霾中细小粉粒状的飘浮颗粒物直径一般在0.01微米以下,可直接通过呼吸系统进入支气管,甚至肺部。所以,霾影响最大的就是人的呼吸系统,造成的疾病主要集中在呼吸道疾病、脑血管疾病、鼻腔炎症等病种上。同时,灰霾天气时,气压降低、空气中可吸入颗粒物骤增、空气流动性差,有害细菌和病毒向周围扩散的速度变慢,导致空气中病毒浓度增高,疾病传播的风险很高。请同学们观看天空气质量日报的污染指数及首要污染物、空气质量级别、空气质量状况。
【学生】回答问题。首要污染物有二氧化硫、二氧化氮、可吸入颗粒
【师】今天我们就来共同探究关于二氧化硫的相关问题
联系实际生活,情景带入
2.探索新知
【PPT展示】关于硫的图片。
【师】这种块状的硫,易研成粉末,在初中我们就见过,请大家在课本上找出有关它的一些性质的描述。
【学生】黄色固体,难溶于水,微溶于酒精,易溶于CS2,易升华等。
【师】讲解二氧化硫
一.二氧化硫的物理性质
状态:气体
颜色:无色
气味:有刺激性
沸点:-10 ℃
毒性:有毒
密度:比空气大
溶解度:易溶于水,在常温、常压下,1体积水大约能溶解40体积的SO2。
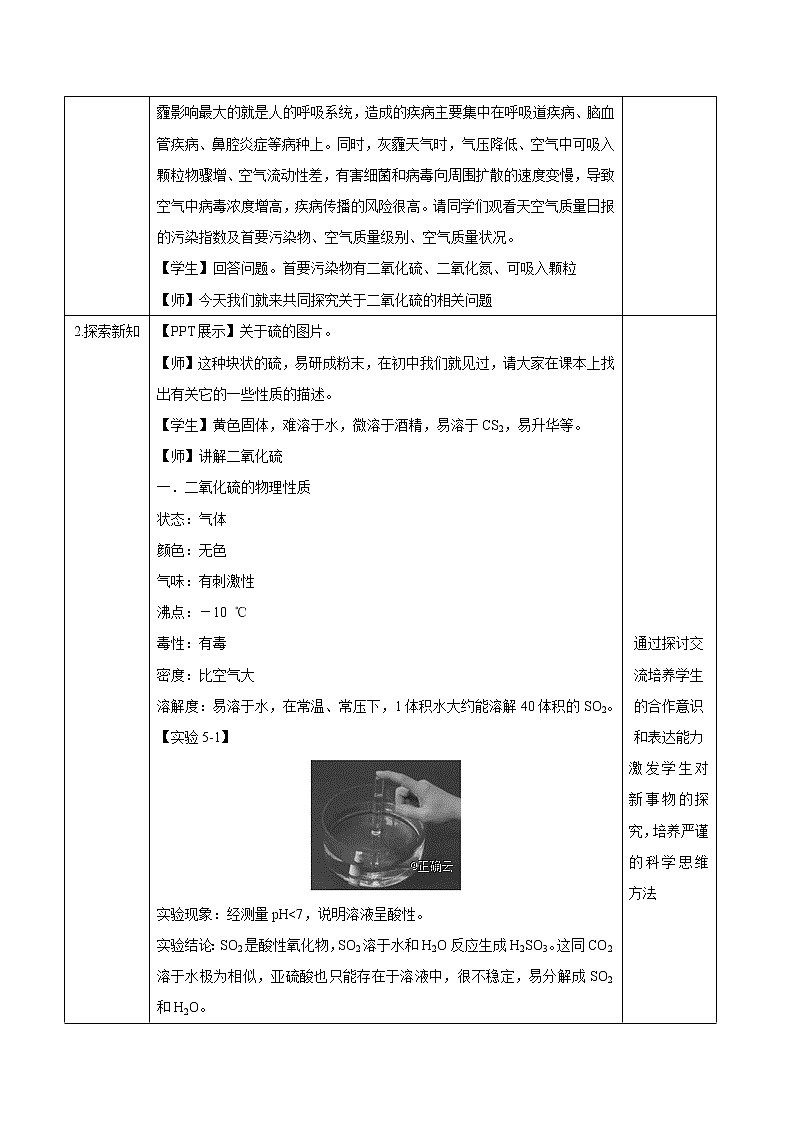
【实验5-1】
实验现象:经测量pH<7,说明溶液呈酸性。
实验结论:SO2是酸性氧化物,SO2溶于水和H2O反应生成H2SO3。这同CO2溶于水极为相似,亚硫酸也只能存在于溶液中,很不稳定,易分解成SO2和H2O。
二.二氧化硫的化学性质
(1)与水反应:SO2 + H2O H2SO3
【师】CO2+H2OH2CO3这两个反应有什么特点呢?
【学生】能同时向两个反应方向进行。
【师】像这种在同一条件下,既能向正反应方向进行,同时又能向逆反应方向进行的反应,叫做可逆反应。
(2)与氧化物反应:
SO2+Ca(OH)2====CaSO3↓+H2O CaSO3+SO2+H2O====Ca(HSO3)2
(3)与NaOH反应:SO2+2NaOH====Na2SO3+H2O
SO2+NaOH====NaHSO3
(4)还原性:2SO2+O22SO3
5SO2+2KMnO4+2H2O====K2SO4+2MnSO4+2H2SO4
SO2+Br2+2H2O====H2SO4+2HBr
(5)氧化性:SO2+2H2S====3S↓+2H2O
(6)漂白性:向品红溶液中通入SO2气体,品红溶液褪色,加热后恢复原色。
【师】SO2能使溴水、KMnO4溶液褪色,这与SO2使品红褪色,实质相同吗?
【师总结】不同。前者缘于SO2的还原性,发生的是氧化还原反应。后者缘于其漂白性,发生的是非氧化还原反应。
三.二氧化硫的主要用途
(1)制硫酸:SSO2SO3H2SO4
(2)漂白纸浆、毛、丝、草帽等
(3)杀菌消毒
拓展:SO2在一定条件下可以转化为SO3,SO3也是一种典型的酸性氧化物。
SO3的熔点16.8 ℃,沸点44.8 ℃,常温常压下,SO3不是气体
四.酸雨
酸雨的形成主要是因雨水中溶入SO2、SO3和一些硫酸盐,但以SO2为主。SO3的形成是因为在空气中飘尘的作用下,一部分SO2被O2氧化,或污染空气的NO2与SO2作用而产生SO3,在降水时SO3也溶于雨水生成H2SO4。
五.SO2与CO2的性质比较
SO2
CO2
相同点
常温下都是气体
密度均大于空气
溶于水后的溶液均可导电
酸性氧化物,都能使澄清石灰水变浑浊,气体过量时又变澄清
Ca(OH)2+SO2===CaSO3↓+H2O
CaSO3+SO2+H2O===Ca(HSO3)2
Ca(OH)2+CO2===CaCO3↓+H2O
CaCO3+CO2+H2O===Ca(HCO3)2
不同点
有刺激性气味,有毒
无味,无毒
易溶于水
可溶于水
具有还原性,能被O2、Cl2、Br2、I2、酸性KMnO4溶液等氧化
无还原性
具有漂白性,能使品红溶液褪色
没有漂白性
酸性:H2SO3>H2CO3
六.常见的CO2、SO2的鉴别方法
试剂
现象及结论
品红溶液
使品红溶液退色的是SO2;不能使品红溶液退色的是CO2
氢硫酸
出现浑浊的是SO2,无明显现象的是CO2
高锰酸钾溶液
使紫色退去的是SO2,无明显现象的是CO2
溴水
使橙色退去的是SO2,无明显现象的是CO2
碘水(含淀粉)
使蓝色退去的是SO2,无明显现象的是CO2
七.常见漂白剂的漂白原理比较
类型
漂白原理
漂白特点
变化类型
举例
氧化型
漂白剂具有强氧化性,因与有色物质发生氧化还原反应而使其褪色
褪色后不会恢复原色
化学变化
HClO、Na2O2、O3、H2O2等
化合型
漂白剂与某些有色物质发生化合反应而使其褪色
一定条件下发生分解,又恢复原色
化学变化
SO2
吸附型
某些固体物质具有疏松多孔的结构,能吸附有色物质
——
物理变化
活性炭等
通过探讨交流培养学生的合作意识和表达能力
激发学生对新事物的探究,培养严谨的科学思维方法
培养学生总结归纳、辩证思维的能力
3.小结作业
完成课后同步练习
高中化学人教版 (2019)必修 第二册第五章 化工生产中的重要非金属元素第一节 硫及其化合物教学设计: 这是一份高中化学人教版 (2019)必修 第二册第五章 化工生产中的重要非金属元素第一节 硫及其化合物教学设计,文件包含人教版2019高中化学必修二51硫及其化合物第1课时教案docx、人教版2019高中化学必修二51硫及其化合物第2课时教案docx、人教版2019高中化学必修二51硫及其化合物第3课时教案docx等3份教案配套教学资源,其中教案共18页, 欢迎下载使用。
人教版 (2019)必修 第二册第一节 硫及其化合物教案设计: 这是一份人教版 (2019)必修 第二册第一节 硫及其化合物教案设计,共6页。教案主要包含了的检验,不同价态含硫物质的转化等内容,欢迎下载使用。
人教版 (2019)必修 第二册第一节 硫及其化合物教案: 这是一份人教版 (2019)必修 第二册第一节 硫及其化合物教案,共5页。教案主要包含了学习目标,自主学习,导学解疑,成果检验等内容,欢迎下载使用。













