
高中化学人教版 (2019)必修 第二册第一节 硫及其化合物第2课时教案设计
展开5.1 硫及其化合物
第2课时 浓硫酸
教学设计
教学目标
知识与技能
(1)了解浓硫酸的三大特性。
(2)认识浓硫酸与稀硫酸性质的不同。
2. 过程与方法
(1)通过实验探究体验科学研究的一般过程,逐步掌握比较研究法,进一步形成交流、反思、评价的学
习习惯。
(2)以硫酸的知识学习为线索,通过多种活动,使学生进一步掌握学习物质及其化学性质的一般方法,
提高自主学习能力。
3.情感态度与价值观
(1)通过对浓硫酸的脱水性的探究实验,加强实验安全教育。
(2)通过探究实验,培养学生的学习兴趣和勇于创新的科学品质。
二、教学重难点
教学重点
浓硫酸的性质。
2.教学难点
浓硫酸的性质。
三、教学过程
四.板书设计
硫及其化合物
一.硫酸的物理性质
二.硫酸的化学性质
三.浓硫酸的三大特性教学环节
教学内容
设计意图
1.新课导入
【PPT】播放硫酸伤人图片、新闻
【师】2002年2月23号清华大学刘海洋同学“为了测试熊的嗅觉”,用浓硫酸泼熊,造成动物园中五只黑熊受到不同程度的伤害,有一只熊生命受到严重的威胁……。
【师】今天我们就来共同探究关于浓硫酸的相关问题
联系实际生活,情景带入
2.探索新知
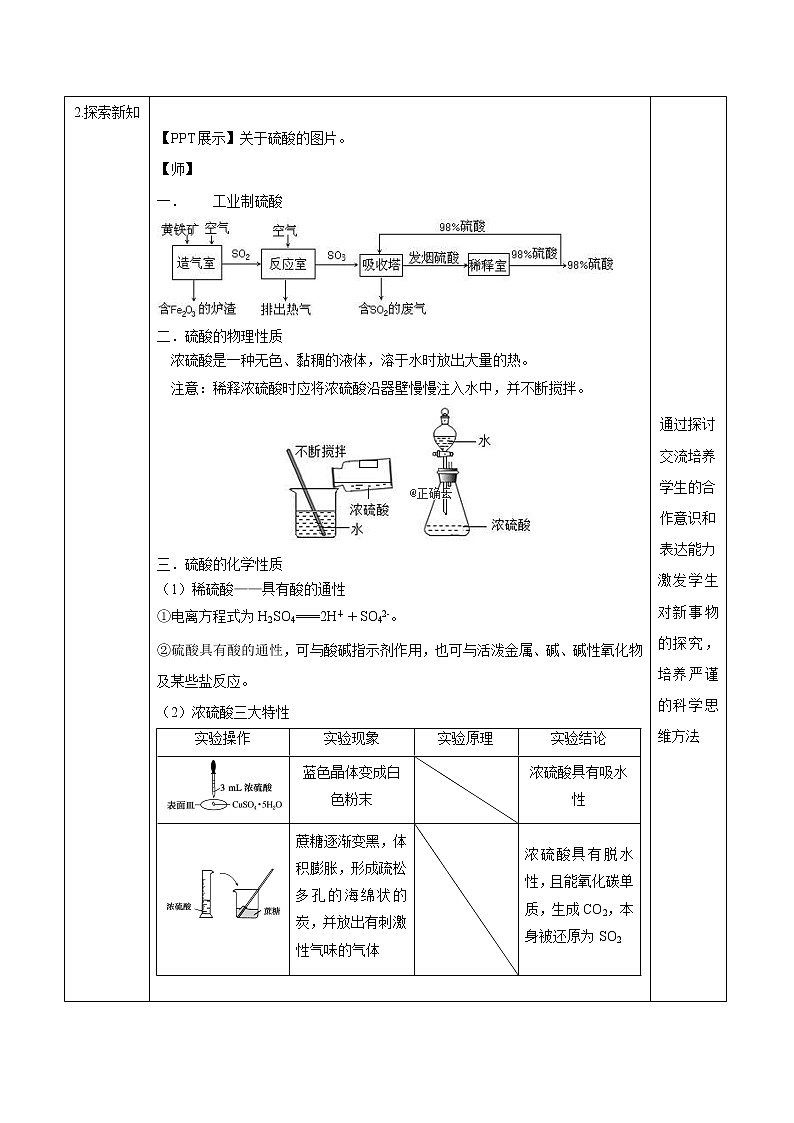
【PPT展示】关于硫酸的图片。
【师】
工业制硫酸
二.硫酸的物理性质
浓硫酸是一种无色、黏稠的液体,溶于水时放出大量的热。
注意:稀释浓硫酸时应将浓硫酸沿器壁慢慢注入水中,并不断搅拌。
三.硫酸的化学性质
(1)稀硫酸——具有酸的通性
①电离方程式为H2SO4===2H++SO42-。
②硫酸具有酸的通性,可与酸碱指示剂作用,也可与活泼金属、碱、碱性氧化物及某些盐反应。
(2)浓硫酸三大特性
实验操作
实验现象
实验原理
实验结论
蓝色晶体变成白色粉末
浓硫酸具有吸水性
蔗糖逐渐变黑,体积膨胀,形成疏松多孔的海绵状的炭,并放出有刺激性气味的气体
浓硫酸具有脱水性,且能氧化碳单质,生成CO2,本身被还原为SO2
加热前铜片在浓硫酸中无现象;
加热后,铜片逐渐溶解,铜片表面有气泡产生;品红溶液褪色
Cu+2H2SO4(浓)eq \(=====,\s\up7(△))CuSO4+SO2↑+2H2O
浓硫酸具有
强氧化性
注意:浓硫酸强氧化性的表现
1.与金属的反应
(1)Fe、Al的钝化
常温下,当Fe、Al遇到浓硫酸时,会与浓硫酸发生反应,表面生成一层致密的氧化物薄膜而出现“钝化”现象。
(2)与位于氢之前的活泼金属反应
Zn+2H2SO4(浓)===ZnSO4+SO2↑+2H2O
规律:①浓硫酸既表现氧化性,又表现酸性;
②浓硫酸一旦变稀,就发生:Zn+H2SO4===ZnSO4+H2↑。
(3)与氢之后的不活泼金属(除Au、Pt外)反应
Cu+2H2SO4(浓)eq \(=====,\s\up7(△))CuSO4+SO2↑+2H2O
规律:①反应需加热,否则不反应;
②氧化产物是硫酸盐,金属显高价,还原产物为SO2;
③浓硫酸既表现氧化性,又表现酸性;
④随反应进行,硫酸浓度变小,一旦变为稀硫酸,反应就会停止。
2.与非金属反应
C+2H2SO4(浓)eq \(=====,\s\up7(△))CO2↑+2SO2↑+2H2O。
3.与还原性化合物的反应
常见的还原性物质FeSO4、Na2S、H2S、HBr、HI等均能被浓H2SO4氧化。
四.浓、稀硫酸的鉴别方法
现象
浓H2SO4
稀H2SO4
物理性质
加入水中
放出大量热
无明显现象
观察状态
黏稠状液体
黏稠度较小的液体
密度
浓H2SO4密度较大,相同体积时,浓H2SO4质量大
化学性质
铁片
因铁被钝化而无明显现象
产生大量气泡
铜片(加热)
有气泡产生,溶液变蓝
无明显现象
白纸
立即变黑
无明显现象
胆矾
蓝色变为白色
无颜色变化
通过探讨交流培养学生的合作意识和表达能力
激发学生对新事物的探究,培养严谨的科学思维方法
培养学生总结归纳、辩证思维的能力
3.小结作业
完成课后同步练习
高中化学人教版 (2019)必修 第二册第五章 化工生产中的重要非金属元素第一节 硫及其化合物教学设计: 这是一份高中化学人教版 (2019)必修 第二册第五章 化工生产中的重要非金属元素第一节 硫及其化合物教学设计,文件包含人教版2019高中化学必修二51硫及其化合物第1课时教案docx、人教版2019高中化学必修二51硫及其化合物第2课时教案docx、人教版2019高中化学必修二51硫及其化合物第3课时教案docx等3份教案配套教学资源,其中教案共18页, 欢迎下载使用。
人教版 (2019)必修 第二册第一节 硫及其化合物教案设计: 这是一份人教版 (2019)必修 第二册第一节 硫及其化合物教案设计,共6页。教案主要包含了的检验,不同价态含硫物质的转化等内容,欢迎下载使用。
高中化学人教版 (2019)必修 第二册第五章 化工生产中的重要非金属元素第一节 硫及其化合物教学设计: 这是一份高中化学人教版 (2019)必修 第二册第五章 化工生产中的重要非金属元素第一节 硫及其化合物教学设计,共13页。教案主要包含了硫的性质和用途,硫的氧化物和氢化物,硫酸,不同价态含硫物质的转化等内容,欢迎下载使用。













