





初中化学第九单元 溶液课题2 溶解度示范课ppt课件
展开问题:食盐溶于水形成溶液,那么一定量水里能无限制溶解食盐吗?
氯化钠不能无限制地溶解在一定量的水中
推论:物质不能无限制地溶解在一定量的溶剂中
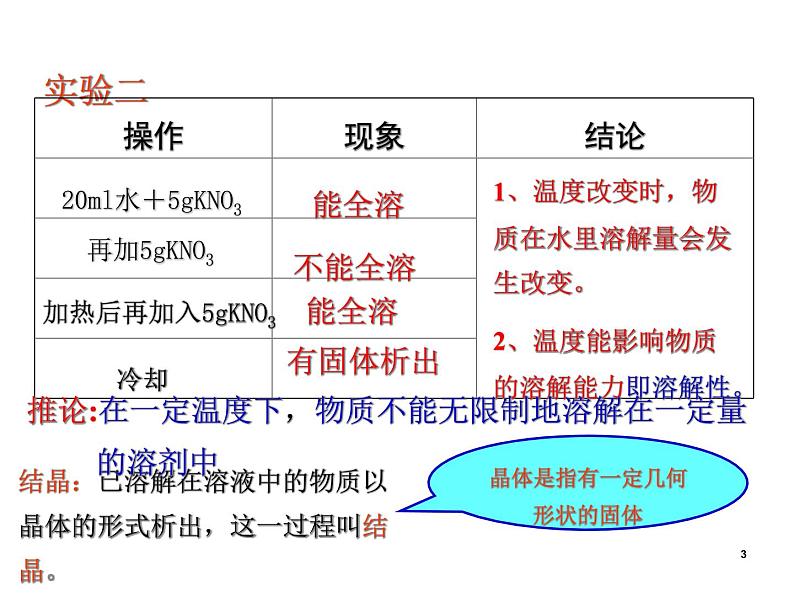
1、温度改变时,物质在水里溶解量会发生改变。2、温度能影响物质的溶解能力即溶解性。
结晶:已溶解在溶液中的物质以晶体的形式析出,这一过程叫结晶。
晶体是指有一定几何形状的固体
20ml水+5gKNO3
加热后再加入5gKNO3
推论:在一定温度下,物质不能无限制地溶解在一定量 的溶剂中
一、饱和溶液与不饱和溶液1、饱和溶液 在一定温度下,向一定量溶剂里加入某种溶质,当该溶质不能继续溶解时所得到的溶液叫做这种溶质的饱和溶液。2、不饱和溶液 在一定温度下,向一定量溶剂里加入某种溶质,当该溶质还能继续溶解时所得到的溶液叫做这种溶质的不饱和溶液。
概念中应注意的三个问题:(1)一定温度(2)一定量的溶剂(3)这种溶质达到饱和时,其他物质可以溶解。
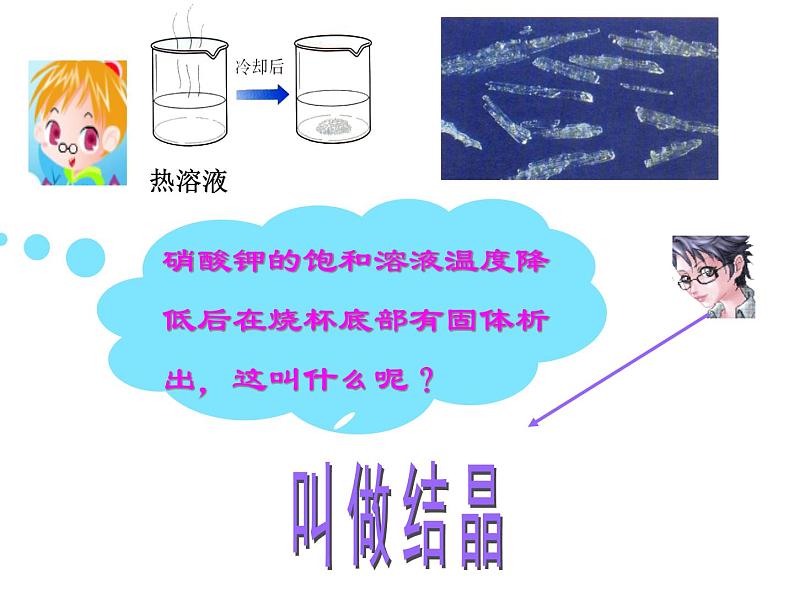
像上面这些是从溶液中析出的具有规则的几何外形的固体 叫做晶体
在生产上,人们常用结晶的方法从溶液中提取溶质。
(1)蒸发溶剂法:如蒸发海水获得食盐;
蒸发溶剂使溶质结晶析出
(2)冷却热饱和溶液法:或称降温结晶法。如冷却热的硝酸钾饱和溶液来获取硝酸钾晶体
冷却热的饱和溶液使晶体析出
1、已知20℃时,100克水中溶解36克NaCl刚好成为饱和溶液。(1)在此温度下, 100克水中加入33克NaCl,得到的溶液是 溶液(填“饱和”或“不饱和”,下同);(2)再加3克NaCl,得到的溶液是 溶液 ; (3)继续加3克NaCl,得到的溶液是 溶液,溶液的质量为 克 。
2、将a g 氯化钠粉末放入b g 水中,充分搅拌后,所得溶液的质量为 ( ) A、等于(a+b)g B、小于(a+b)g C、大于(a+b)g D、不大于(a+b)g
3、饱和溶液与不饱和溶液的转化(水溶液)
“升温”和“降温”两种方法适合大多数固态溶质的溶液,对极少数固体(如:氢氧化钙)来说恰好相反。
1. 20℃时,100g 饱和氯化钠溶液若保持温度不变,使其成为不饱和溶液的方法是 ( ) ;2. 20℃时,接近饱和的石灰水,使其成为饱和溶液的方法是( )。
3、20℃,往50g硝酸钾溶液中加入5g硝酸钾晶体,充分搅拌后,尚有部分晶体未溶解,稍加热后,晶体全部溶解。下列说法正确的是 ( ) A、搅拌后加热前一定是饱和溶液 B、搅拌后加热前一定是不饱和溶液 C、加热后一定是饱和溶液 D、加热后一定是不饱和溶液
4、饱和溶液和不饱和溶液与溶液浓和稀的关系
浓溶液: 单位质量溶液中含溶质较多的溶液。
稀溶液: 单位质量溶液中含溶质较少的溶液。
(1)饱和溶液不一定是浓溶液,可能是稀溶液(2)不饱和溶液不一定是稀溶液,可能是浓溶液(3)同温度下,同物质的饱和溶液比它的不饱和溶液浓
1、在温度为t℃时,某物质的饱和溶液一定是( ) A、稀溶液 B、含有100g溶剂的溶液 C、浓溶液 D、不能再溶解该物质的溶液
2.某物质的饱和溶液中,加入一些该溶质的固体,则下列说法正确的是( ) A.溶质质量减少; B.溶液质量增大; C.固体质量不变; D.溶质质量增加.
一种物质溶解在 另一种物质里的能力
问题1:为了定量比较NaCl和KNO3的溶解性(即溶解能力)强弱,小丽同学设计了以下四种方案,你认为是否可行?说明原因。
问题2:在100g水中溶解NaCl和KNO3达到饱和状态时,测得溶解的溶质的质量如表所示,请你比较两种物质的溶解能力。
请同学们利用表中的数据,定量描述20℃时硝酸钾的溶解性。
这种定量描述固体物质溶解性的方法就叫固体物质的溶解度。
1、定义: 在一定温度下,某固态物质在100g溶剂里达到饱和状态所能溶解的溶质质量(g),叫做这种物质在这种溶剂里的溶解度。
①一定温度下②溶剂量为100g(确定)③状态达饱和(确定)④溶质质量(单位为g)
问题3: 判断下列说法是否正确: (1)在20℃时,100g水中溶解了23g食盐,则食盐在20℃时的溶解度为23g。 (2)在100g水中最多能溶解36.0g NaCl达到饱和状态,则氯化钠的溶解度为36.0g。 (3)在20℃时,在100g水中最多能溶解36.0gNaCl达到饱和状态,则20℃时,氯化钠的溶解度为36.0g。
问题4 “在80℃时,KNO3的溶解度为169克”这句话的含义是什么?请完成下表。
问题5 已知在20℃时,NaCl的溶解度为36g,将20g氯化钠放入50g水中充分搅拌,求所得溶液的质量。
【问题】从表格中能否查到13℃时硝酸钾的溶解度?那怎么办?
几种物质在不同温度时的溶解度
(2)图像法——固体物质溶解度曲线
横坐标表示温度(℃)纵坐标表示溶解度(g)
问题6观察溶解度曲线可以看出三种不同类型的曲线: (1)大多数固体物质的溶解度随温度的升高而____,例如硝酸铵、硝酸钠、硝酸钾,曲线特点是“陡升型”。 (2)少数固体物质的溶解度受温度的影响不大,代表物质是________,曲线特点是“缓升型”。 (3)极少数固体物质的溶解度随温度的升高而____,代表物质是________,曲线特点是“下降型”。
(二)气体物质的溶解度
1、定义:某气体在一个标准大气压下,一定温度时,溶解在1体积水中达到饱和状态时的气体体积数。
气体溶解度随温度的升高而降低,随压强的增大而增大。
2、影响气体溶解度的因素
思考:①能不能用刚凉好的凉白开养鱼?②给冷水加热的时候,在沸腾以 前,水中为什么会出现很多气泡?
1、下列说法是否正确?(1)食盐在水里的溶解度是36g。(2)20℃时,硝酸钾的溶解度为31.6。(3)20℃时,50g水中加入18g食盐后溶液恰好饱和,因此,20℃时,食盐在水中的溶解度为18g。
2、20℃时,食盐的溶解度为36g。在此温度下,50g水中加入了20g食盐,充分溶解后所形成溶液的质量为 ( ) A、70g B、60g C、68g D、136g
化学人教版课题2 溶解度示范课课件ppt: 这是一份化学人教版课题2 溶解度示范课课件ppt,共59页。PPT课件主要包含了第2课时溶解度,应该在同一温度下,这样行吗,应该溶剂的量相同,应该达到饱和状态,定状态达到饱和,定温度,定溶剂的量,溶解度,溶解度4要素等内容,欢迎下载使用。
人教版九年级下册课题2 溶解度教课内容ppt课件: 这是一份人教版九年级下册课题2 溶解度教课内容ppt课件,共16页。PPT课件主要包含了试试身手,不饱和溶液,饱和溶液,①增加溶剂,②升高温度,①增加溶质,③蒸发溶剂,②降低温度,晶体的定义,结晶的方法等内容,欢迎下载使用。
化学课题2 溶解度教课内容课件ppt: 这是一份化学课题2 溶解度教课内容课件ppt,共60页。PPT课件主要包含了溶剂水,实验2,固体溶解,固体有剩余,想一想,应该在同一温度下,溶剂量应该相同,应该达到饱和状态,固体溶解度的概念,饱和状态等内容,欢迎下载使用。













