





化学课题2 溶解度教课内容课件ppt
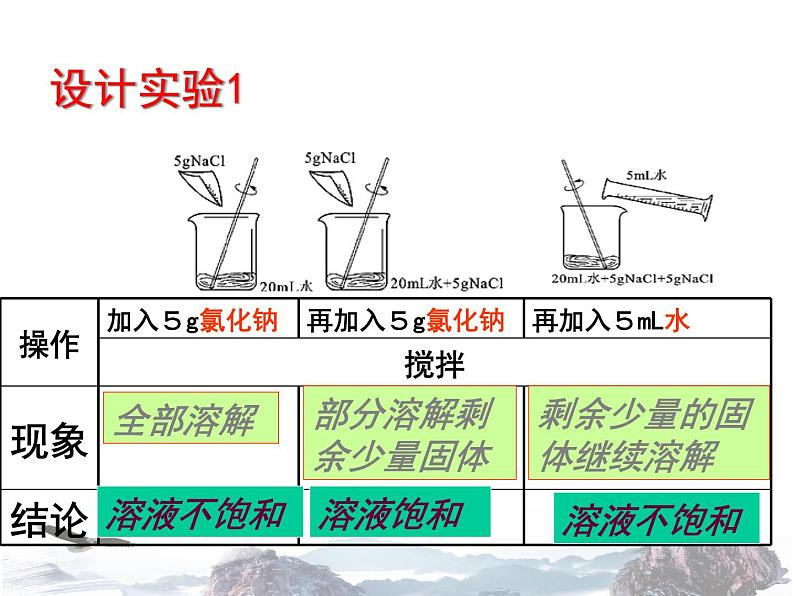
展开探究1:可溶物在一定量的水中能否无限溶解?
可溶物:氯化钠、硝酸钾
最多能溶解多少氯化钠,是无限制的溶解吗
剩余少量的固体继续溶解
【结论】物质不能无限量地溶解在一定量的水中。水的量增多,溶解的物质也增多。
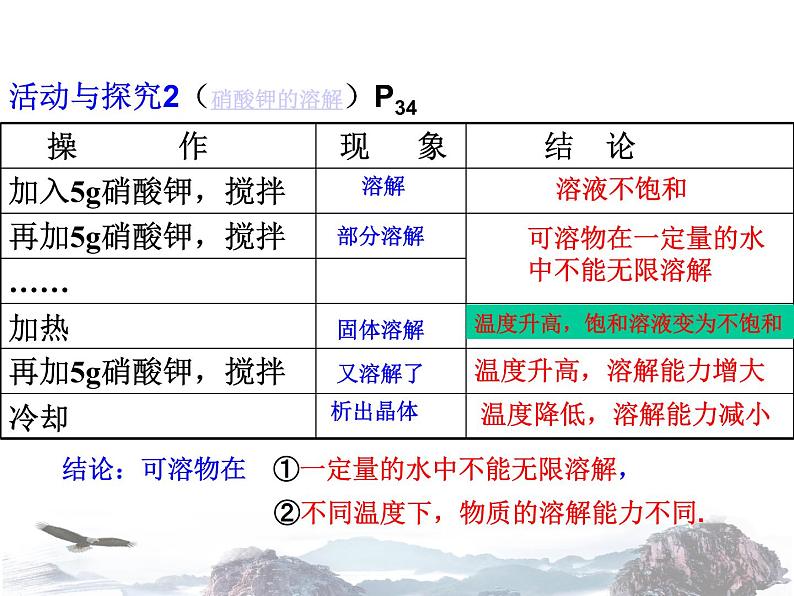
活动与探究2(硝酸钾的溶解)P34
可溶物在一定量的水中不能无限溶解
温度升高,饱和溶液变为不饱和
温度升高,溶解能力增大
温度降低,溶解能力减小
结论:可溶物在 ①一定量的水中不能无限溶解,
②不同温度下,物质的溶解能力不同.
加热后,硝酸钾又能溶解了
【结论】温度升高,一定量的水中可以溶解更多的物质;温度降低,一定量的水中溶解的物质的量减少。
【小结】溶剂中溶解溶质的多少与溶剂的量和温度有关。
冷却热的饱和溶液时,硝酸钾晶体从溶液中析出
一:饱和溶液和不饱和溶液
【饱和溶液】在一定温度下,在一定量的溶剂里不能再溶解某种溶质的溶液,叫做这种溶质的饱和溶液。
【不饱和溶液】在一定温度下,在一定量的溶剂里还能继续溶解某种溶质的溶液,叫做这种溶质的不饱和溶液。
(1) 一般说来,可以向原溶液中再加入少量原溶质,如果不能再溶解,则说明是饱和溶液;如果还能再溶解,则说明是不饱和溶液。(2)有未溶解的溶质时为该温度下的饱和溶液。
二、判断溶液是否饱和的方法:
一定温度下,某溶质的饱和溶液加入其他溶质能溶解吗?
设计实验:往装有少量硝酸钾饱和溶液的试管中加入1-2小粒KMnO4
1.硝酸钾的饱和溶液能 继续溶解高锰酸钾
2.此液为硝酸钾饱和溶液
饱和溶液能溶解其他溶质
探究2 饱和与不饱和溶液的转化
2、不饱和溶液与饱和溶液间的转化关系
现有一瓶接近饱和的硝酸钾溶 液,使它变成饱和溶液的方法中, 不正确的是( )
A、加入硝酸钾固体 B、降低溶液的温度C、蒸发一部分溶剂后再恢复到原 温度 D、用滴管吸出一部分溶液
饱和溶液一定是浓溶液,不饱和溶液一定是稀溶液吗?
10毫升水 + 2克食盐:振荡,现象:溶液类型:10毫升水 + 0.2克熟石灰 :振荡,现象:溶液类型:
[总结一] 浓溶液不一定是饱和溶液,稀溶液不 一定是不饱和溶液。
[总结二] 同一物质,相同温度,饱和溶液比不 饱和溶液要浓。
1.在一定温度下,某物质的饱和溶液一定是A.很浓的溶液 B.很稀的溶液C.不能继续溶解该物质的溶液D.不能溶解任何物质的溶液.
2.某物质的饱和溶液中,加入一些该溶质的固体, 则下列说法正确的是A.溶质质量减少;B.溶液质量增大;C.固体质量不变;D.溶质质量增加.
3.一定温度下,从500克的饱和溶液中倒出100克溶液,剩余的溶液里,下列数值比原溶液减少的是①溶质的质量; ②溶剂的质量; ③溶液的密度; ④溶液的质量; ⑤溶质的质量分数(即:浓度); ①②③④ B. ②③④⑤C ①② ④. D.①②③④⑤
4.为什么汗水带咸味?被汗水浸湿的衣服晾 干后,为什么常出现白色的斑痕?
5.有一瓶蒸馏水和一瓶稀氯化钾溶液,用什么简单的方法 把它们区分开?
答:人分泌的汗水,是氯化钠溶液.因为溶有氯化钠,所以带咸味.凉干,是将水分蒸发,所以有氯化钠析出。
6、某课外小组需一定浓度的KNO3溶液做实验,怎样使KNO3固体较快地溶于水中?说明理由。
建议1:溶解时加热,粒子扩散速度加快,使溶解速度加快
建议2;溶解时不断的搅拌,使粒子运动速度加快,迅速扩散到溶剂中去。
建议3:溶解前先将固体研碎,增大固体与水的接触面积,使溶解速度加快
1.不同物质在水中溶解能力是否相同?举例说明。
答:不同。例如食盐在水中溶解能力较大,而熟石灰在水溶解能力很差。
2.同种物质在不同溶剂中溶解能力是否相同?
答:不同。例如油易溶于汽油而难溶于水。
与溶质和溶剂的性质、及温度有关
一种物质溶解在另一种物质的能力
溶解性能力的大小常用溶解度来表示
如何定量的比较物质的溶解性呢?
能否说明KNO3 比NaCl 易溶与水呢?
20℃ ,100g水,饱和
20℃,100g水,饱和
定量比较固体溶解能力大小的要素:
讨论:设计实验——怎样比较食盐和蔗糖哪一个更易溶于水?
在一定温度下,某固态物质的在100克溶剂里达到饱和状态时所溶解的质量,叫做这种物质在这种溶剂里的溶解度。
影响固体物质溶解度的因素
温 度
溶解度与溶质,溶剂的质量无关
从溶解度可以获得的信息
食盐在20℃时的溶解度S=36克在 ___℃时,食盐(氯化钠)在_____ 克水里达到 ____ 时溶解了____克。此时的溶液一定是______溶液。该溶液的质量为_________。溶液中食盐(NaCl)的质量为________ ,水为___ 。归纳:若某物质在某温度时的溶解度为S克,则此时M质 = S克,M剂 = 100克,M液= M质+M剂 = 100+S 克
例:判断正误:1.l00g水中最多溶解38g氯化钠,所以氯化钠在水中的溶解度是38g。( )2.在10℃时,烧杯内水中最多溶有140g硝酸铵,所以硝酸铵在水中的溶解度是140g。( )3.在60℃,100g水中溶有75g硝酸钾,所以60℃时硝酸钾的溶解度为75g。( )4.60℃,100g水中最多溶解124g硝酸钾,所以硝酸钾在这温度下的溶解度是124。( )
1、在20℃时,100g水中溶解36g氯化钠溶液达到饱和,则20 ℃时氯化钠溶解度是____g。
2、在0℃时,100g水中最多可溶解13.3g硝酸钾,则0℃时硝酸钾溶解度是____g。
3、20℃时硝酸钾的溶解度是31.6g,这句话的含义是什么?将其关系代入下表:
【学法点拨】利用数轴、图形或表格,可以使复杂的内容变得系统、简单。
2、溶解度与溶解性的关系
练习: 1、不溶物就是绝对不溶于水的物质。此话是否正确? 2、20℃时碳酸钙的溶解度是0.0013g,所以碳酸钙是___溶物质。 3、20℃时氯化钠的溶解度是36g,则氯化钠属于( ) A.易溶 物质 B.可溶物质 C.微溶物质 D.难溶物质
溶解度随温度变化有两种表示方法:①列表法; ②溶解度曲线。
4.固体溶解度的表示方法
⑴溶解度曲线: 由于固体物质的溶解度随温度变化而变化,随温度一定而一定,这种变化可以用溶解度曲线来表示。我们用纵坐标表示溶解度,横坐标表示温度,绘出固体物质的溶解度随温度变化的曲线,这种曲线叫做溶解度曲线。
硝酸钾在不同温度时的溶解度:
3、溶解度的表示方法:
熟石灰的溶解度随温度升高而降低
1:同种物质在不同温度下的溶解度不同。
2:曲线的交点表示这两种物质在该温度下的溶解度相同。
3:曲线越陡,该物质的溶解度受温度影响越大。
找一找50度各物质的溶解度
1、横坐标60,纵坐标110 的交点表示什么意义?
2.比较硝酸钠与硝酸钾的溶解度大小
在680C时,NaNO3与KNO3的溶解度相等
温度大于680C时, KNO3的溶解度大于NaNO3
温度小于680C时,NaNO3的溶解度大于KNO3
氯化铵、氯化钾、氯化钠、硼酸
讨论: 固体物质溶解度受温度变化影响情况:
大多数固体物质溶解度随温度升高而增大,例如 硝酸钾等。
少数固体物质溶解度受温度影响不大,例如食盐。
极少数固体物质溶解度随温度升高反而减小,例如熟石灰。
固体物质溶解度受温度变化的规律:
的溶解度随温度升高而增大
的溶解度受温度影响不大
的溶解度随温度升高反而减小
甲、乙两种固体的溶解度曲线如下图。现将两试管分别装入甲、乙两种物质的饱和溶液(试管底部均有未溶解的固体),再放进盛有冰水的烧杯里, 则下列说 法正确的是( ) A.甲溶液中溶质的质量分数增大 B.乙溶液中剩余的固体减少 C.试管里甲、乙物质的溶解度都增大 D.试管里甲、乙两溶液中的溶质都减少
再放进盛有冰水的烧杯里, 则下列说
右图是A.B两种物质的溶解度曲线,试回答下列问题(1)t1ºC时,A 的溶解度 B 的溶解度.(填< > 或=)(2)A、B两物质饱和溶液溶质的质量分数相等的温度是 ºC。(3)当A、B两物质的溶液接近饱和时,采用增加溶质、蒸发溶剂、降低温度的方法可以达到饱和的是 物质的溶液。
从溶解度曲线分析结晶情况
1、降温结晶(又叫冷却热饱和溶液法)
适用于溶解度随温度变化较小的物质如:NaCl
适用于溶解度随温度变化较大的物质如:KNO3
滤液中:大部分NaCl 少量KNO3
硝酸钾固体中含有少量氯化钠,如何提纯硝酸钾?
降温结晶法提纯硝酸钾(又叫冷却热饱和溶液法)
①溶解在溶液里的溶质以晶体的形式析出,叫做结晶。
冷却后硝酸钾晶体从溶液中析出
②固体溶质 溶液里的溶质
注意:没溶解的溶质不能计算在溶液中
④海水晒盐,原理: 利用日光、风力使水分蒸发。是蒸发溶剂法
粗盐的主要成分:不溶性泥沙、氯化钠
1、使用什么方法可将粗盐中的泥沙除去?
2、除去泥沙后,再怎样操作才能得到食盐晶体?
例:小明绘制的两种固体物质的溶解度曲线如右图所示:(1)30 ℃时,甲物质的溶解度为 。(2)由右图还可获得的信息有:
(2004宜昌)氯化钠和碳酸钠晶体的溶解度(0℃~30℃)如下表所示:
Na2CO3.10H2O
(1)从溶解度表中,我获取的信息有: , 。(2)要分离氯化钠和碳酸钠晶体的混合物,我设计的实验操作步骤是 。
NaCl的溶解度随温度变化较小
碳酸钠的溶解度随温度变化较大
①甲物质的溶解度受温度变化影响很大
②乙物质的溶解度受温度变化影响较小
③20 ℃时,甲、乙两物质的溶解度相等
④10 ℃时,甲、乙两物质的溶解度大小关系是乙﹥甲
⑤30 ℃时,甲、乙两物质的溶解度大小关系是甲﹥乙
⑥甲物质的结晶方法是:冷却热饱和溶液
⑦乙物质的结晶方法是:蒸发溶剂
①高温时配成饱和溶液,②冷却热饱和溶液,③过滤;滤纸上是碳酸钠晶体,滤液是氯化钠溶液;④蒸发滤液得氯化钠晶体
生活中,气体溶解在水中的例子
【活动与探究】探究影响气体溶解度的一些因素。
与压强有关;压强减少,气体溶解度减少。
①喝完汽水后,常常会打嗝,打嗝时,气体在 水中的溶解度如何改变?②汽水被喝下后,什么条件发生了改变?③气体在水中的溶解度与什么因素有关?
与温度有关;温度升高,气体溶解度减少。
通常讲的气体溶解度是指该气体在压强为101KPa, 一定温度时溶解在1体积水里达到饱和状态时的气体体积。
0℃时,氧气的溶解度为0.049的含义是什么?
在0℃,氧气压强为101kPa时,1体积水最多能溶解0. 049体积氧气
1标准大气压下,20℃时部分气体的溶解度
气体溶解度一般随压强增大而增大,压强减小而减小。
气体溶解度一般随温度升高而减小,温度降低而增大。
影响气体溶解度的因素:
[讨论] 天气闷热时,鱼儿为什么总爱在水面上进行呼吸?
天气闷热,温度升高,气压减小,空气的在水中的溶解度随温度升高而减小,随气压减小而减小,水中氧气含量减小;而水面与空气接触,氧气含量相对多些,所以,鱼浮出水面呼吸。
措施:安一个喷水泵,将水喷向空中
为什么要向鱼缸中通入空气
把水喷向空中可以增加养鱼池水中氧气的溶解量
1. 增大二氧化碳在水中的溶解度的方法( ) A. 升温增压; B. 升温减压; C. 降温增压; D. 降温减压。
2.下列几种物质①硝酸钾②熟石灰③氧气④二氧化碳 溶解度随温度的升高而增大的是( ) A.①② B.③④ C.①③④ D.只有①
3.饱和溶液降低温度析出晶体后,剩下的溶液是( )A.稀溶液 B.浓溶液 C.不饱和溶液 D.饱和溶液4.20℃时,从某饱和蔗糖溶液中取出一部分后,则剩下的溶液一定是( )A.饱和溶液 B.不饱和溶液 C.变浓 D.变稀5.一瓶接近饱和的硝酸钾溶液,逐渐加入硝酸钾固体,下列图像(如图所示)中符合溶液中溶质质量变化的是( )
(09潍坊)6甲、乙两种固体物质的溶解度曲线如右图。下列说法正确的是( )
A.甲物质的溶解度为60gB.t℃时,甲、乙两物质的溶解度相等C.升高温度可使不饱和的甲溶液变为饱和溶液D.20℃时,乙物质的溶解度小于甲物质的溶解度
(09乐山)7 右图是a、b两种固体的溶解度曲线,下列说法正确的是 ( )A.a、b两种物质的溶解度都随温度的升高而增大B.在t2℃时,b的溶解度比a的溶解度大C.在t1℃时,a、b两种饱和溶液中溶解的溶质质量相等D.在t2℃时,将20 g a物质加到100 g水中,溶液质量是120 g
如图8A、B、C三种物质在水中的溶解度曲线,请回答:
t2ºC时,A和C物质溶解度相等
(1)M点的含义是 。
(2)当温度为t1ºC,三种物质溶解度由大到小依次为 , t3ºC时,溶解度最大的是 。
(3)t3℃时,将30gA放入50g水中,充分溶解后所得的溶液是 (填“饱和”或“不饱和”)溶液。溶液质量是 。
(4)t3℃时,A物质溶解于100克水中形成的饱和溶液,但温度降至t1℃时,析出A 克;
9:80℃时,将110g硝酸钾加入到100g水中,充分溶解后,形成的溶液为该温度下硝酸钾的____溶液。欲使其刚好形成饱和溶液,可采用的方法有:
若再降温到10℃,会怎样?
会析出89g硝酸钾晶体
初中化学人教版九年级下册第九单元 溶液课题2 溶解度评课课件ppt: 这是一份初中化学人教版九年级下册第九单元 溶液课题2 溶解度评课课件ppt,共27页。PPT课件主要包含了活动探究,课堂练习,影响因素,想一想等内容,欢迎下载使用。
初中化学人教版九年级下册第九单元 溶液课题2 溶解度教学演示课件ppt: 这是一份初中化学人教版九年级下册第九单元 溶液课题2 溶解度教学演示课件ppt,共25页。PPT课件主要包含了混合物分离的方法,过滤法,应用粗盐提纯,①溶解,②过滤,③蒸发,④转移,玻璃棒转移,结晶法,1冷却热饱和溶液等内容,欢迎下载使用。
人教版九年级下册课题2 溶解度课堂教学课件ppt: 这是一份人教版九年级下册课题2 溶解度课堂教学课件ppt,共20页。PPT课件主要包含了曲线上的点表示,曲线的交点表示,曲线表示含义,巩固练习,检测提高,归纳提升,问题组二,☞从化学走进生活,我们的收获等内容,欢迎下载使用。













