


初中化学人教版九年级上册第三单元 物质构成的奥秘课题2 原子的结构课文配套课件ppt
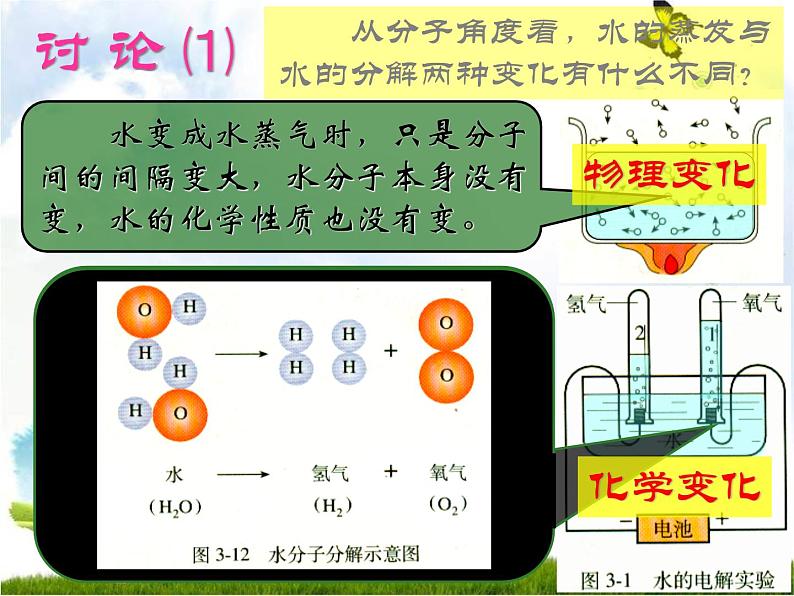
展开从分子角度看,水的蒸发与水的分解两种变化有什么不同?
水变成水蒸气时,只是分子间的间隔变大,水分子本身没有变,水的化学性质也没有变。
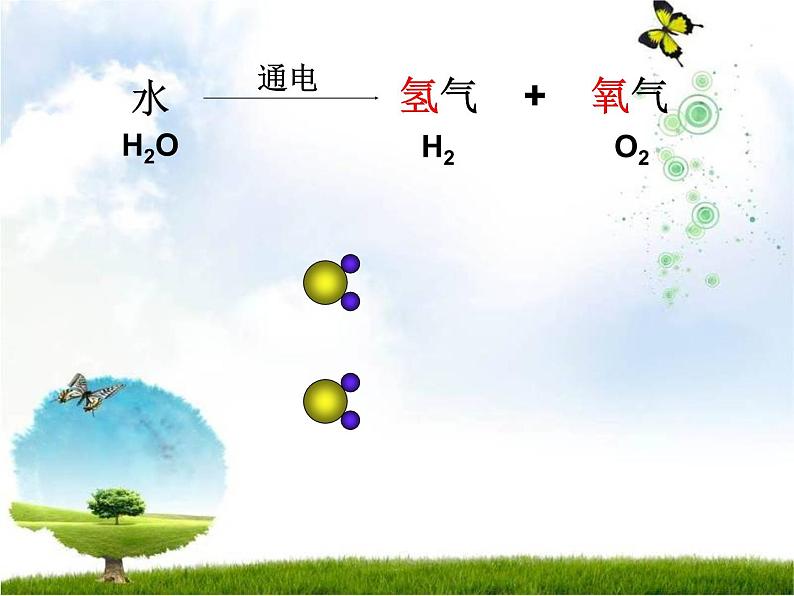
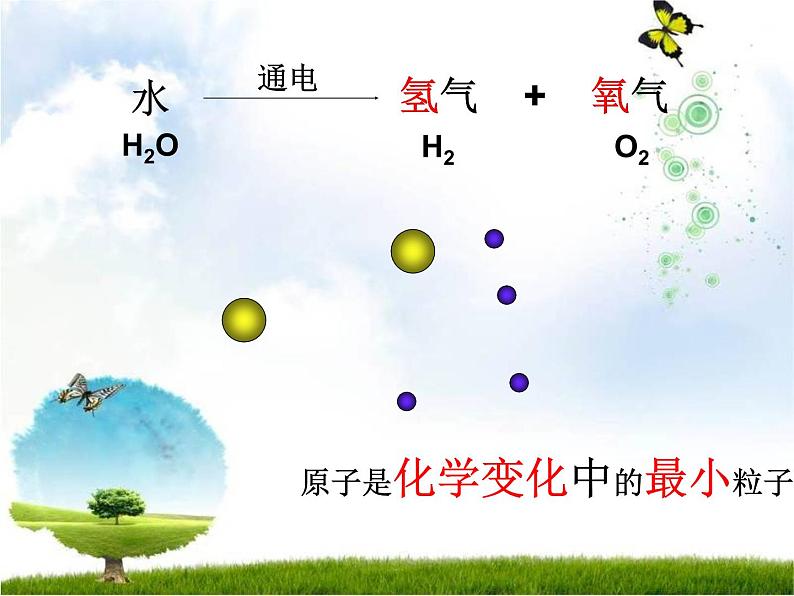
水电解时,水分子变成了氢分子和氧分子,不再保持水的化学性质。在反应里,水分子分成氢原子和氧原子,每2个氢原子结合成1个氢分子,每2个氧原子结合成1 个氧分子。
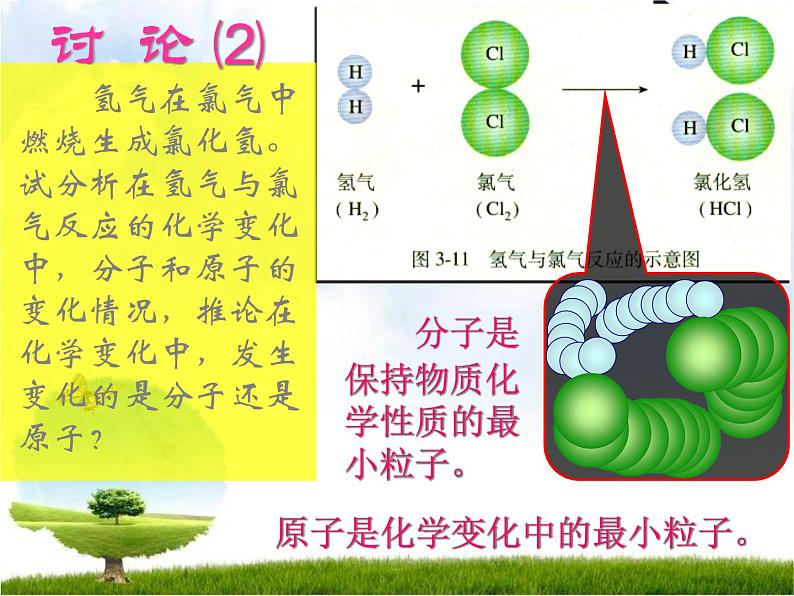
氢气在氯气中燃烧生成氯化氢。试分析在氢气与氯气反应的化学变化中,分子和原子的变化情况,推论在化学变化中,发生变化的是分子还是原子?
分子是保持物质化学性质的最小粒子。
原子是化学变化中的最小粒子。
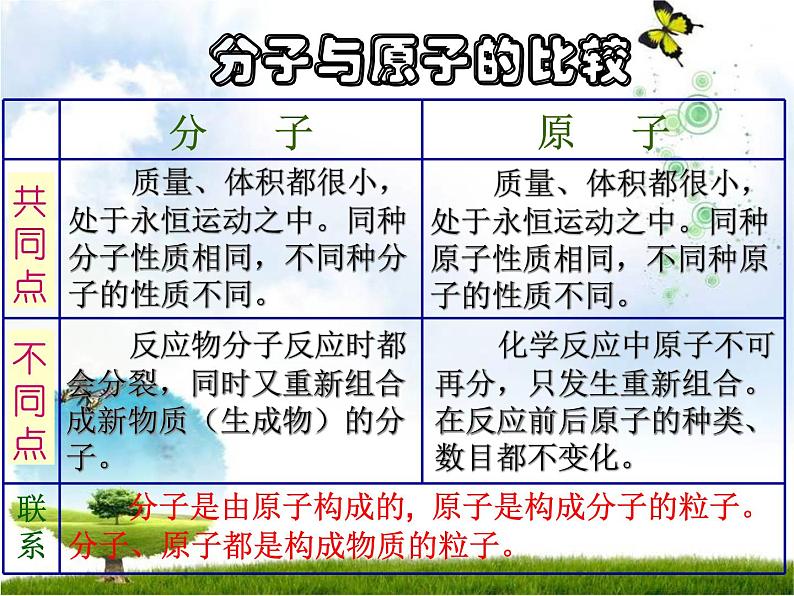
质量、体积都很小,处于永恒运动之中。同种分子性质相同,不同种分子的性质不同。
质量、体积都很小,处于永恒运动之中。同种原子性质相同,不同种原子的性质不同。
反应物分子反应时都会分裂,同时又重新组合成新物质(生成物)的分子。
化学反应中原子不可再分,只发生重新组合。在反应前后原子的种类、数目都不变化。
(1) 什么是原子? (2)原子在化学变化中可不可以再分?
氢气 + 氧气
原子是化学变化中的最小粒子。
原子真的不能再分?
19世纪初,英国科学家道尔顿提出近代原子学说,他认为原子是微小的不可分割的实心球体。
1897年,英国科学家汤姆生发现了电子。
4、1911年,卢瑟福提出原子模型:在原子的中心有一个很小的核,它的质量几乎等于原子的全部质量,电子在核外空间饶着核旋转。
1919年以后,通过卢瑟福以及不少科学家的反复实验,发现了原子核是由带正电荷的质子和不带电荷的中子构成的。
1911年,英国科学家卢瑟福用一束平行高速运动的α粒子(α粒子是带两个单位正电荷的氦原子,其质量比电子大的多)轰击金箔时,发现:1.大多数α粒子能穿透金箔,而且不改变原来的运动方向,2. 也有一小部分α粒子改变了原来的运动路径,3.有极少数的α粒子好像碰到了坚硬不可穿透的质点而被弹了回来(如右图)。
金原子不为实心球体,中间有个核。
(1)大多数α粒子能穿透金箔, 而且不改变原来的前进方向。(2)一小部分的α粒子运动方向发生偏转。(3)极少数的α粒子好像碰到了坚硬不可 穿透的质点而被弹了回来。
(1)原子内部空间很大, 大多数α粒子 不改变运动方向而直接穿过去。
(2)一小部分α粒子受到正电荷的斥力, 运动方向发生偏转。
(3)原子中的正电荷集中在原子中心很 小的区域内, α粒子正好撞在该区 域上被弹了回来。
1个质子带一个单位正电荷;
1个电子带一个单位负电荷。
☆核电荷数=质子数=核外电子数
(每个质子带一个单位正电荷)
(每个电子带一个单位的负电荷)
[提问]通过此表格,你得到了哪些信息?
边学边练:谁得出的结论最多
1、在原子中质子数等于核外电子数2、原子核一般由质子和中子构成有的原子不一定有中子(如氢原子)3、质子数不一定等于中子数4、原子种类不同,则核内质子数不同
1 下列关于原子的说法中,不正确的是( )A.原子是化学变化的最小微粒,但原子可以再分B.核外电子在原子核外的空间里作高速运动C.原子核是由质子和电子构成的,呈电中性D.原子可以构成分子,也可以构成物质
2、原子(普通的氢除外)中的原子核是( )A、由电子和质子构成 B、由质子和中子构成C、由电子和中子构成 D、不能再分3、在原子里质子数等于( )A、中子数 B、 中子数和电子数之和 C、电子数 D、质子数与电子数之差
4、在①分子;②原子;③原子核;④质子;⑤中子;⑥电子等微粒中,找出符合下列条件的微粒填在相应的横线上。 (1)能保持物质化学性质的微粒是 ; (2)化学变化中的最小微粒是 ; (3)带正电荷的微粒是 ; (4)不显电性的微粒是 ; ( 5)质量最小的微粒 ;
2.据中央电视台报道,考古学家通过测定古生物遗骸中 的碳-14原子的含量来推测古生物的年代。碳-14原子 的质子数是6,原子核内的粒子总数是14,下列有关 碳-14原子的叙述正确的是( ) A.其核外有8个电子 B.其核内有6个中子 C.核电荷数为6 D.质子数大于中子数
1.据报道,科学家发现了一种新的原子,它的原子核内 有161个中子,电子数为111。该原子的质子数为( )。 (A)111 (B)161 (C)272 (D)433
已知某种原子里质子数是11,中子数比质子数多1,求这种原子中的粒子总数?
原子核(带正电)
核外电子(带负电)
相对原子质量:以一种碳原子质量的1/12为标准,其他原子的质量跟它相比较所得到的比,作为这种原子的 相对原子质量(符号为Ar)
相对原子质量:以一种碳原子质量的1/12作为标准,其它原子的质量跟它相比较所得的比,就是这种原子的相对原子质量(符号为Ar)。
注意点: ①相对原子质量只是一个比,不是原子的实际质量。 ②相对原子质量的标准是一个碳12原子质量的1/12, 而不是一个碳12原子质量。 ③相对原子质量的单位是“1”,而不是“千克”、“克”等。 ④相对原子质量大的其原子的实际质量也大。
2、作为相对原子质量标准的碳原子的质量为n千克,则原子质量为A 千克的原子的相对原子质量是( )
1、一个氧原子的质量是2.657×10-26千克, 作为标准的碳原子的质量的1/12是 1.66×10-27千克。求氧原子的相对原子质量。
张青莲 国际原子量委员会委员
1、 原子核( )A、 由电子和质子构成的 B、由质子和中子构成C、由电子和中子构成 D、由质子、中子和电子构成的2、 在原子里质子数等于( )A、 中子数 B、电子数 C、 中子数和电子数之和 D、中子数和电子数之差
比一比,看谁查得又快又准:
1、查阅相对原子质量表
(1)根据P153附录Ⅱ查得相对原子质量为:
(2)根据P73表4-3查出下列原子的相对原子质量:
相对原子质量≈质子数 + 中子数
2、镁原子的质量大约是碳12原子质量的2倍,则镁原子的相对原子质量为( ) A、2 B、24g C、3.984×10-26Kg D、24
3、铝原子的相对原子质量为27,中子数为14,那么它的质子数是多少?
3、 氧原子的相对原子质量是( ) A、 16g B、16 C、2.657×10-26 kg D、16kg4、 原子的质量主要取决于( ) A、质子数和电子数 B、质子数和中子数 C、中子数和电子数 D、质子数、中子数和电子数
下列对原子组成说法不正确的是( ) A、 原子构成中一定有质子 B、 原子构成中一定含有中子 C、 原子构成中的质子数一定等 于电子数 D、 原子不带电
1、将①分子②原子③质子④中子⑤电子等粒子用序号分别填 入下列适当空格中: (1)构成物质的基本粒子是________________(2)构成原子的基本粒子是________________(3)显示电中性的粒子是________________(4)带正电的粒子是________________(5)参加化学反应一定发生变化的粒子是____________(6)原子中数目一定相等的粒子是_______________
初中化学人教版九年级上册第三单元 物质构成的奥秘课题2 原子的结构优秀ppt课件: 这是一份初中化学人教版九年级上册第三单元 物质构成的奥秘课题2 原子的结构优秀ppt课件,共22页。PPT课件主要包含了学习目标,提出问题等内容,欢迎下载使用。
2021学年课题2 原子的结构优秀ppt课件: 这是一份2021学年课题2 原子的结构优秀ppt课件,共29页。PPT课件主要包含了学习目标,复习提问,原子的构成,新课导入提问,自主学习,部分原子结构示意图,熟练记忆,核外电子排布规律,讨论2,小组内交流讨论等内容,欢迎下载使用。
九年级上册第三单元 物质构成的奥秘课题2 原子的结构课堂教学课件ppt: 这是一份九年级上册第三单元 物质构成的奥秘课题2 原子的结构课堂教学课件ppt,共5页。PPT课件主要包含了原子的构成,原子核外电子的排布,内容提要,相对原子质量,学习目标,新知学习,英国科学家汤姆森,汤姆森原子模型,物理学家卢瑟福,α粒子轰击金箔实验等内容,欢迎下载使用。













