






化学九年级上册课题2 原子的结构背景图课件ppt
展开人教版新课标九年级册第三单元课题2
原子是最小的微粒吗?他真的不能再分割下去了吗?
19世纪初,英国科学家道尔顿提出近代原子学说,他认为原子是微小的不可分割的实心球体。
1、一切物质都是原子构成。2、原子是坚实的实心球体。3、原子是不可再分的
英国化学家道尔顿(J.Daltn , 1766~1844)
道尔顿提出近代原子学说三个观点现在都是错误的.
原子并不是构成物质的最小微粒 ——汤姆生发现了电子(1897年)
电子是种带负电、有一定质量的微粒,普遍存在于各种原子之中。 汤姆生认为电子就像西瓜子一样镶嵌在原子中
英国物理学家汤姆生( ,1856~1940)
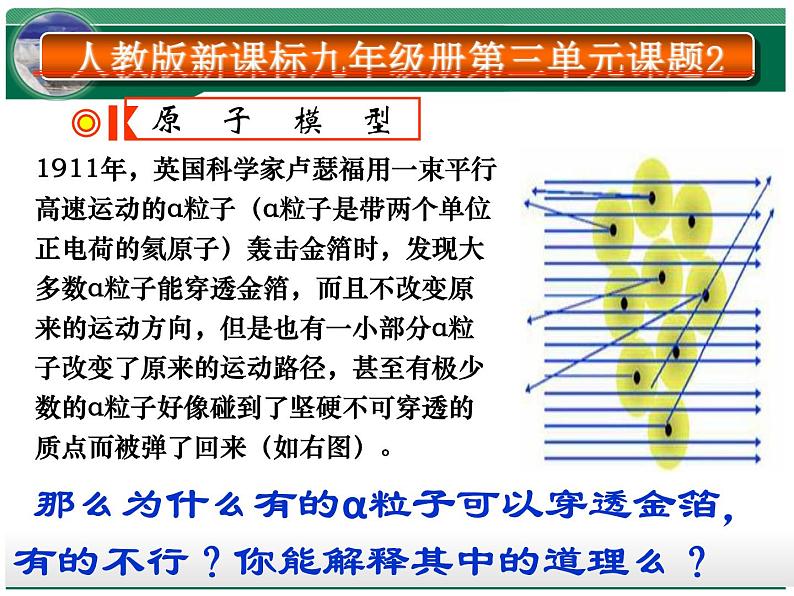
卢瑟福在1911年提出原子有核模型
原子是由居于原子中心的带正电的原子核和核外带负电的电子构成。原子核的质量几乎等于原子的全部质量,电子在原子核外空间绕核做高速运动。就像行星环绕太阳运转一样。 (又称行星原子模型)
1911年,英国科学家卢瑟福用一束平行高速运动的α粒子(α粒子是带两个单位正电荷的氦原子)轰击金箔时,发现大多数α粒子能穿透金箔,而且不改变原来的运动方向,但是也有一小部分α粒子改变了原来的运动路径,甚至有极少数的α粒子好像碰到了坚硬不可穿透的质点而被弹了回来(如右图)。
那么为什么有的α粒子可以穿透金箔,有的不行?你能解释其中的道理么?
【现象一】绝大多数的 α粒子通过金箔并按原方向运动。 【结论一】原子内部十分空旷且电子质量很小
【现象二】少数一部分α粒子改变了原来的运动方向【结论二】原子内部存在着与α粒子(+)电性相同的粒子
【【现象三】极少部分α粒子竟被反射回来结论三】原子内部存在着质量比α粒子大的多的粒子(原子核)。
根据α粒子轰击金箔所出现的现象,你认为该支持哪个科学家的原子结构理论呢?
归纳:原子由居于原子中心的带正电的原子核和核外带负电的的电子构成。
每个质子带一个单位的正电荷
每个电子带一个单位的负电荷
想一想在原子中哪些粒子带电,哪些粒子不带电?
原子核、质子、核外电子带电,原子、中子不带电
表格3-1 几种原子的构成
讨论题:1.原子中有带电粒子,那么整个原子是否带电?为什么?2.是否是所有的原子中都含有中子?3.原子中质子数、电子数、中子数有何不同?4.不同类原子的内部构成有什么不同?
钠原子的结构(11个电子)
核外电子是分层排布的:电子层:1 2 3 4 5 6 7 K L M N O P Q离核:近 远能量:低 高能量低的在离核近的区域运动,能量高的在离核远的区域运动
⑴第一层最多容纳___个电子,第二层最多容纳___个电子。
(2)最外层不超过 个电子。
⑶电子先排满能量 的电子层,然后再排能量 稍 的电子层。
【小知识】物质都有趋向于稳定状态的特点 ( 如:水往低处流;树上的苹果往下掉)。原子也不例外,也有趋向于稳定结构的特点。那么,什么样的结构才是原子的稳定结构呢?
稀有气体元素的原子结构示意图
最外层具有8个电子(只有一个电子层的具有2个电子)的结构,属于相对稳定结构。
元素与最外层电子数的关系
金属元素原子的结构示意图
金属元素,最外层电子一般少于4个,在化学反应中易失去电子,形成相对稳定结构
非金属元素原子结构示意图
非金属元素,最外层电子一般多于4个,在化学反应中易得到电子,形成相对稳定结构。
根据元素的原子最外层上的电子数可以1、判断元素的类别。 2、推测元素的化学性质。 元素的化学性质与原子结构的最外层电子数有密切关系。最外层电子数相同,元素的化学性质相似。
电子的分层排布和原子结构示意图能够帮助我们做什么?
[例1]六种粒子结构示意图分别为:(1)A、B、C、D、E、F共表示 种元素。(2)表示原子的粒子是 (填序号,下同)。
找朋友——形成稳定的结构!
钠在氯气中点燃生成氯化钠的形成过程:
二、离子:带有电荷的原子或原子团。 离子带的电荷数等于该原子(或原子团)失去或得到电子的数目。
表示每个镁离子带2个单位的正电荷
练习:说出下符号的意义
原子中: 核电荷数 质子数 核外电子数阳离子: 核电荷数 质子数 核外电子数阴离子: 核电荷数 质子数 核外电子数
写出铝离子、镁离子、氧离子、氯离子的离子 符号并画出它们的结构示意图。(友情提示:先画出它们的原子结构示意图)
Al3+ Mg2+ O2- Cl-
某离子带3个单位的正电荷,质子数为13,该离子的核外电子数为_____,该离子的名称是______,符号是____,该离子的结构示意图是:
1.原子和阴,阳离子之间是怎样相互转化的?
2.原子与离子之间有什么区别和联系?
①离子是由原子得失电子形成
②都能构成物质,保持物质化学性质
①原子是化学变化中的最小微粒
①离子是带电的原子或原子团
由分子构成的物质: 氧气 氢气 氮气 二氧化碳 二氧化硫 五氧化二磷 水
由原子构成的物质: 稀有气体:氦气 氖气金属:铁 铜 汞 铝固体非金属:碳 硫 磷
氯化钠 氯化钾
你们知道一个原子的质量到底有多大吗?
一个碳原子的质量是:0.00000000000000000000000001993千克即1.993×10-26千克一个氧原子的质量是: 0.00000000000000000000000002657千克即2.657×10-26千克一个氢原子的质量是:0.00000000000000000000000000167千克即1.67×10-27千克
原子的质量很小,书写、使用都很不方便,怎么办?
二【相对原子质量】以一种碳原子质量的1/12为标准,其他原子的质量跟它相比较所得的比,作为这种原子的相对原子质量。(符号为Ar)
≈ 1.66×10-27Kg
已知:氢原子的质量=1.67×10-27Kg
已知:氧原子的质量=2.657×10-26Kg
注意: 1、相对原子质量不是原子的实际质量,是一个比值。2、单位:为1(一般不写)
原子的质量很小,主要集中在原子核上
跟质子、中子相比,电子质量很小,通常忽略不计,因此原子的质量主要集中在原子核上。
找规律:阅读上表,你能得到什么信息?
1、核电荷数=核内质子数=核外电子数
2、相对原子质量≈质子数+中子数
3、跟质子、中子相比,电子质量很小,通常忽略不计,因此原子的质量主要集中在原子核上。
张青莲教授是我国科学院院士,于1983年当选为国际原子量委员会委员,主持测定了铟、铱、锌等元素的相对原子质量,为相对原子质量的测定作出了卓越贡献。这是国际上第一次采用中国测定的相对原子质量数据。这不仅说明中国人的科学水平有国际竞争能力,更重要的是为中国人民长了志气。
1908年7月- 2006年12月
2、据报道,上海某医院正研究用放射性碘治疗肿瘤,这种碘原子的核电荷数是53,相对原子质量是125,下列关于这种原子的说法错误的是 ( ) A.质子数是53 B.核外电子数是53 C.中子数是53 D.质子数与中子数之和是125
3、从“分子、原子、质子、中子、电子、原子核、”中,选出适当的微粒名称填写下列空白。 (1)在化学变化中,一定发生变化的微粒是 。 (2)在原子结构中不显电性的是 ,带正电荷的是 ,带负电荷的是 。 (3)一般来说,同一种原子里,数目一定相等的是 。 (4)构成原子的微粒有 。 (5)构成物质的微粒有 。
4、我国曾发射一颗绕月探测卫星,其任务之一是寻找一种新能源——氦-3原子,氦-3原子原子核是由1个中子和2个质子构成的,其原子的核外电子数为( ) A、1 B、2 C、3 D、6
3.相对原子质量:以一种碳原子质量的1/12作为标准,其它原子的质量跟它相比较所得的比,就是这种原子的相对原子质量。
2.原子里:核电荷数=质子数=核外电子数
相对原子质量=质子数+中子数
人教版九年级上册第三单元 物质构成的奥秘课题2 原子的结构图片课件ppt: 这是一份人教版九年级上册第三单元 物质构成的奥秘课题2 原子的结构图片课件ppt,共16页。PPT课件主要包含了原子结构示意图,大家来判断,离子的形成,NaCl等内容,欢迎下载使用。
化学人教版课题2 原子的结构教学演示ppt课件: 这是一份化学人教版课题2 原子的结构教学演示ppt课件,共28页。PPT课件主要包含了自主学习,氯化钠的形成过程,钠原子,氯原子,钠离子Na+,氯离子Cl-,NaCl,离子的定义,离子分类,离子的表示等内容,欢迎下载使用。
初中化学课题2 原子的结构课堂教学ppt课件: 这是一份初中化学课题2 原子的结构课堂教学ppt课件,共21页。PPT课件主要包含了课前练习,新课学习,释疑解惑等内容,欢迎下载使用。













