




化学九年级上册课题2 原子的结构图片ppt课件
展开原子是怎样构成的?
核外电子是怎样绕原子核运动的呢?有规律吗?
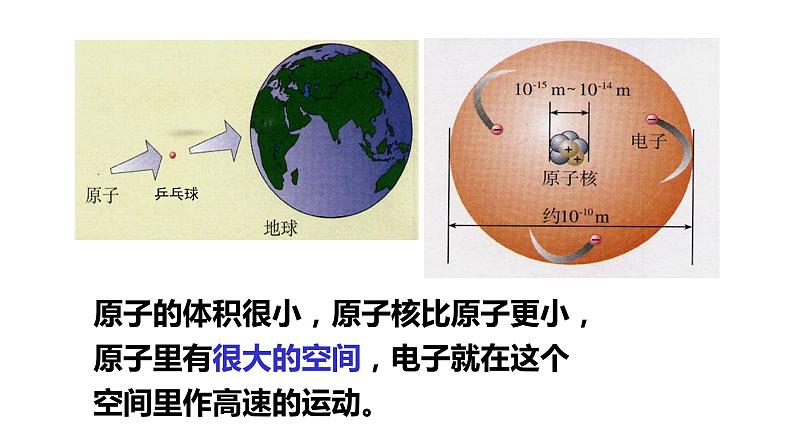
原子的体积很小,原子核比原子更小,原子里有很大的空间,电子就在这个空间里作高速的运动。
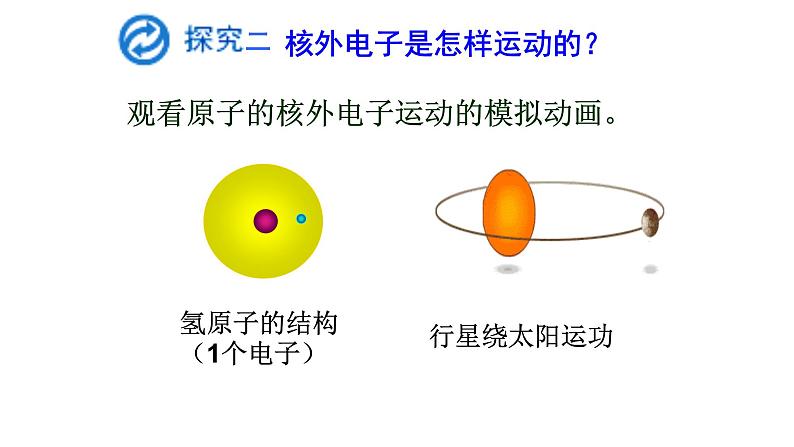
氢原子的核外电子运动情况
核外电子是怎样运动的?
观看原子的核外电子运动的模拟动画。
氢原子的结构(1个电子)
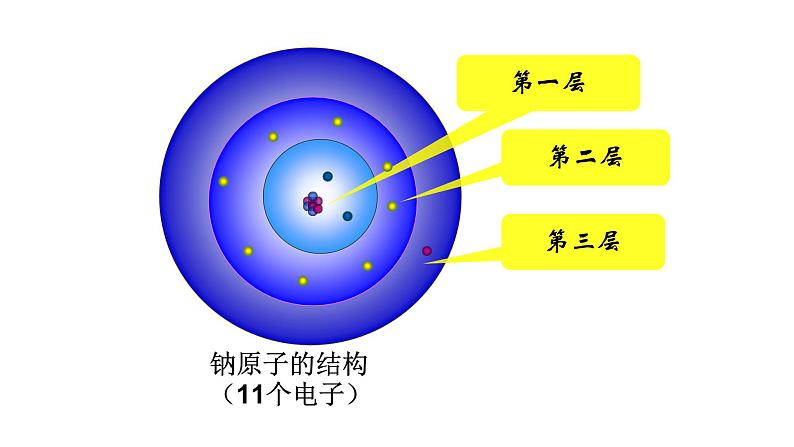
电子在原子核外一定区域内出现,这些区域叫作叫做“电子层”,核外电子是在不同的电子层内运动的,此现象叫做核外电子的分层排布。
钠原子的结构(11个电子)
电子不像行星绕太阳旋转有固定的轨道,但有经常出现的区域,科学家把这样的区域称为电子层。
【思考】电子在核外的空间里做高速的运动。它们会相互碰撞打架吗?电子在核外的排布会有什么特点?
一 .核外电子的分层排布
1、核外电子的运动特点:核外电子按照能量的不同,在不同的电子层内运动,这种现象叫做核外电子的分层排布。
电子层(n)1 2 3 4 5 6 7 距核 近 远 能量 低 高 (不是所有的原子都有七个电子层。最少的有1层,最多的有7层。)
2、分层依据:各电子的能量不同能量低的电子,就在离核近的区域运动; 能量高的就在离核远的区域运动.
核外电子排布的一般规律:
1、第一层最多排2个,第二层最多8个,最外层电子数不超过8个。(第一层为最外层时不超过2个) 2、排满第一层2个电子,再排第二层,排满第二层8个电子,再排第三层。核外电子总是优先排在能量较低的电子层
1 2 3 4 5 6 7
能量低的在离核近的区域运动,能量高的在离核远的区域运动。
1、核外电子的不同运动状态
2、 电子层:电子经常出现的区域
3 、核外电子的分层运动,又叫核外电子的分层排布。
【思考】能否用一个更简明的图形来表示原子的结构及原子核外电子的排布特点呢?
为了形象地表示原子的结构,人们就创造了“原子结构示意图”这种特殊的图形。
第三层(1个)(最外层)
3. 原子结构示意图:
3. 某原子的原子结构示意图为 ,该原子的核电荷数为 ,核外有 个电子层,第二层上有 个电子,最外电子层上有 个电子。
写出下列元素的符号,画出其原子结构示意图。 硫(16 ) 镁(12) 氯(17) 氟(9)
在原子中:核电荷数=质子数=核外电子数=原子序数 质子数=各层电子数之和
同周期:1、从左到右,质子数、最外层电子数递增, 2、电子层数=周期序数 3、电子层数相等同族:1、从上到下,电子层数递增,2、最外层电子数相等
按照规律,写出从 1 到 18 号元素的原子结构示意图,你能从中总结出什么规律?
1. 金属元素的原子最外层电子数一般少于 4 个( H、He、B 除外)。 2. 非金属元素的原子最外层电子数一般等于或多于4 个。
3. 稀有气体元素的原子最外层电子数一般等于 8 个(He 为 2 个)。
物质都有趋向于稳定状态的特点(如:水往低处流,树上的苹果往下掉等现象)。 原子也不例外,同样也有趋向于稳定结构的特点。那么,什么样的结构才是原子的稳定结构呢?
稀有气体元素的最外层电子数等8(除氦元素是2外).在化学变化中,性质稳定.因此把最外层电子数是8(最外层是第一层时,电子数是2)的结构,称为稳定结构.
金属元素的原子一般通过失去最外层电子,使次外层成为最外层,来达到稳定结构
金属元素的原子达到稳定结构的方式
非金属元素的原子达到稳定结构的方式
非金属元素的原子,一般通过最外层得到电子来达到稳定结构
元素的性质与原子核外最外层电子数的关系
【结论】元素的性质,特别是化学性质由原子最外层电子数决定!
三、元素分类、原子结构与元素化学性质的关系
很难与其他物质发生化学反应
【结论】元素的化学性质主要由最外层电子数决定。最外层电子数相同化学性质也相似。
1、 决定元素的种类。是区分不同元素的依据。2、 决定着元素的化学性质,最外层电子数相同,化学性质相似
下列五种微粒中最易失去电子的是 ,最易得到电子的是 , 属于同种元素的是————,原子化学性质相似的是————.。属于金属元素的是______,原子结构示意图______,离子结构示意图_____。
A B C
D E
1.决定元素化学性质的是( )A质子数 B最外层电子数 C中子数 D原子量2.同种元素的原子和离子一定具有相同的( )A核电荷数 B电子层数 C最外层电子数 D带电量3.某元素原子核外有3个电子层,最外层上有1个电子,该元素的核电荷数 为( ) A 5 B 11 C 1 D 184.根据4种粒子结构示意图,下列说法正确的是( )①它们都带有电荷 ②它们都具有稳定结构 ③它们核外电子排布相同 ④它们属于不同种元素A①② B②③ C②④ D③④
初中化学人教版九年级上册第二单元 我们周围的空气课题2 氧气教课内容课件ppt: 这是一份初中化学人教版九年级上册第二单元 我们周围的空气课题2 氧气教课内容课件ppt,共30页。PPT课件主要包含了谜语引入,复习提问,氧气的物理性质,淡蓝色液体,淡蓝色固体,检验氧气,验满氧气,支持燃烧,氧气的化学性质,讨论P34等内容,欢迎下载使用。
初中化学人教版九年级上册课题2 氧气教课ppt课件: 这是一份初中化学人教版九年级上册课题2 氧气教课ppt课件,共21页。PPT课件主要包含了课题2氧气,物理性质,溶解性,比空气密度略大,不易溶于水,气体无色,液体淡蓝色,固体淡蓝色,-183℃,-218℃等内容,欢迎下载使用。
人教版九年级上册课题2 氧气课文配套ppt课件: 这是一份人教版九年级上册课题2 氧气课文配套ppt课件,共24页。PPT课件主要包含了新课引入,一氧气的性质,氧气的物理性质,氧气的化学性质,缓慢氧化,氧气的性质等内容,欢迎下载使用。













