



九年级上册课题2 原子的结构示范课课件ppt
展开如果把一个原子和一个乒乓球放在一起,大家对它的大小比例有什么想法呢?
思考:原子这么小,还能不能再分呢?
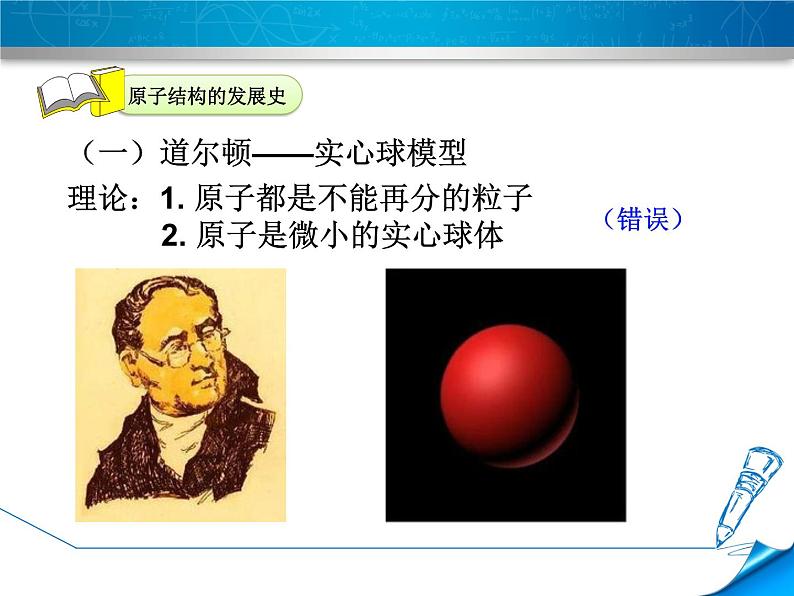
(一)道尔顿——实心球模型
理论:1. 原子都是不能再分的粒子 2. 原子是微小的实心球体
(二)汤姆生——枣糕模型
原子是一个带正电荷的球,电子镶嵌在里面
(三)卢瑟福——行星模型
原子的大部分体积是空的,电子按照一定轨道围绕着一个带正电荷的很小的原子核运转
(四)玻尔——量子化轨道
在行星模型的基础上提出了核外电子分层排布的原子结构模型
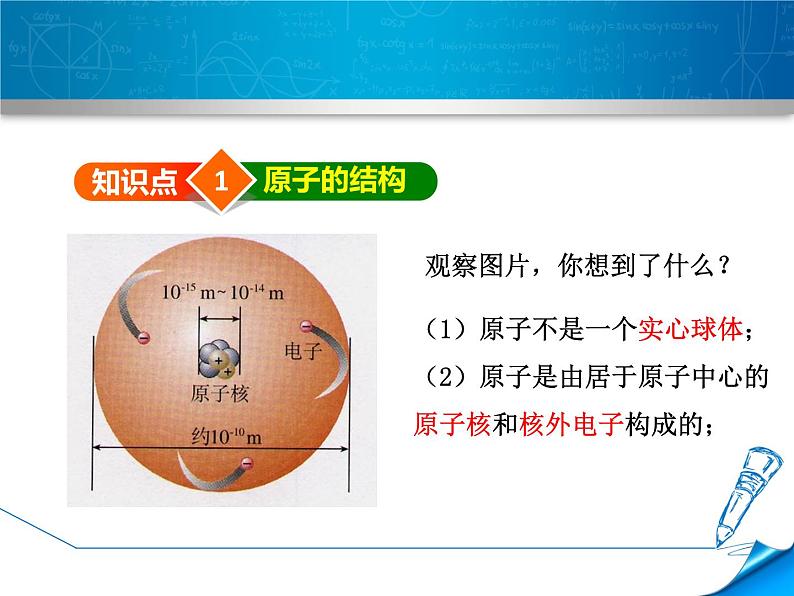
观察图片,你想到了什么?
(1)原子不是一个实心球体;(2)原子是由居于原子中心的原子核和核外电子构成的;
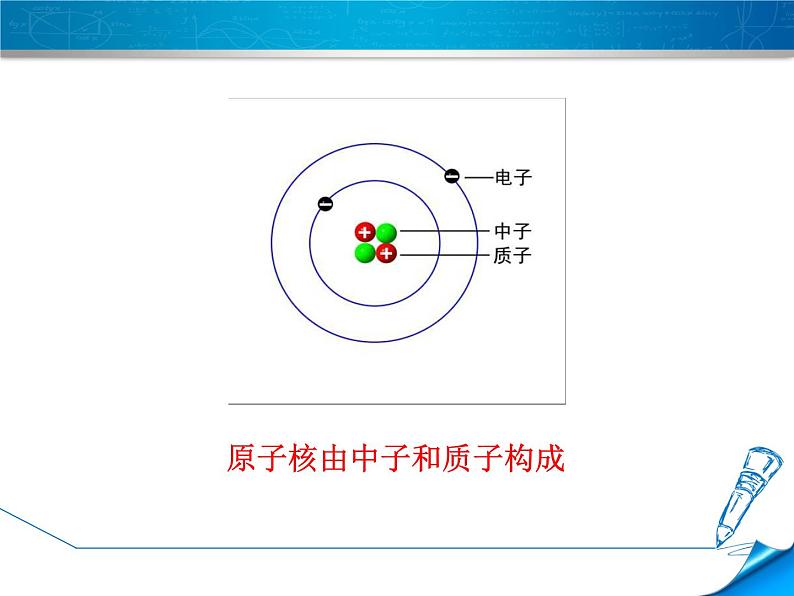
原子核由中子和质子构成
思考:构成原子核、核外电子如何运动?
原子核外运动空间大,电子在这个空间里做高速运动
阅读上表,你能得出什么结论呢?
1、质子带正电,中子不带电,电子带负电。
2、质子和中子的质量很小,但比电子大很多。
3、中子不带电,所以原子核的电性由质子决定, 因此原子核带正电,数目跟质子相等。
4、原子的质量主要集中在原子核上
原子中各粒子之间的关系及带电情况
由于原子里质子数等于核外电子数,一个质子和一个核外电子所带的电量相等,电性相反,所以整个原子不显电性。
原子构成的规律:(1)核电荷数 = 质子数 = 核外电子数(原子核所带的电荷数简称为核电荷数)(2)原子中不一定含有中子,例如:氢原子。(3)不同种类的原子,质子数和电子数都不相同。
关于原子结构,要注意以下几点:1.原子都由原子核和核外电子构成,原子核一般由质子和中子构 成,一般来讲,原子由质子、中子、电子构成,但并不是所有 的原子中都含有这三种粒子,如普通的氢原子中只含有质子和 电子,不含有中子;2.原子核的体积很小,核外有相对较大的空间,原子的质量主要集 中在原子核上3.原子可再分,但原子是化学变化中的最小粒子,在化学变化中原 子不可再分。
【例】原子的构成示意图如图,下列叙述正确的是( ) A.原子是实心球体 B.质子、中子、电子均匀地分布在原子中 C.质子与电子质量相等 D.整个原子的质量主要集中在原子核上
1 原子核中一定含有的粒子是( ) A.中子 B.质子 C.电子 D.质子和中子
2 如图是某同学学习物质结构层次后以氧气为例进行的梳理,下列选项中与a、b、c对应的分别是( ) A.原子、原子核、核外电子 B.原子核、原子、核外电子 C. 原子、核外电子、原子核 D.核外电子、原子核、原子
3 下列关于原子的叙述错误的是( ) A.原子不显电性 B.原子是实心球体 C.原子由原子核和核外电子构成 D.原子可以构成分子
【例】 紫薯中含有被誉为“抗癌大王”的硒元素。已知硒原子的核电荷数为34,中子数为44,则硒原子的核外电子数为( )A.10 B.34 C.44 D.78
1.制取氧气的三种方法对应的化学式2.分子的基本性质(4条)3.分子、原子的概念(分别是什么的最小粒子)4.分子、原子的本质区别5.纯净物、混合物的组成与分子的关系
每个质子带一个单位的正电荷
每个电子带一个单位的负电荷
质子数=核外电子数=核电荷数=原子序数
1.分层排布(高速运动) 电子层 一 二 三 四 五 六 七
核电荷数=核外电子数=质子数=原子序数
各电子层上电子数的排列规律如下:第一电子层上最多排2个电子,第二电子层上最多排8个电子,最三层最多排8个电子。
【例】如图是硫原子的原子结构示意图,下列对硫原子 的叙述正确的是( ) A.硫原子第一电子层有6个电子 B.硫原子核内有16个质子 C.硫原子最外层电子的能量低于第二层电子的 能量 D.硫原子达到了相对稳定的结构
原子结构与化学性质的关系
原子的最外层电子数决定原子的化学性质。
一般来说,原子最外层电子数相同,化学性质相似,但是也有特例,如氦原子与镁原子的最外层电子数相同,化学性质都不相似。
人教版第三单元 物质构成的奥秘课题2 原子的结构课堂教学ppt课件: 这是一份人教版第三单元 物质构成的奥秘课题2 原子的结构课堂教学ppt课件,共4页。PPT课件主要包含了学习目标,Na+,Mg2+,S2-,Cl-,Ca2+,Al3+,O2-,离子及其分类,失去e-等内容,欢迎下载使用。
化学人教版第三单元 物质构成的奥秘课题2 原子的结构说课ppt课件: 这是一份化学人教版第三单元 物质构成的奥秘课题2 原子的结构说课ppt课件,共4页。PPT课件主要包含了五课后反思,三教学流程,一教材分析,二教法与学法,四板书设计,说课流程,教材分析,教学目标,教学的重点难点,重点原子的构成等内容,欢迎下载使用。
化学人教版课题2 原子的结构评课ppt课件: 这是一份化学人教版课题2 原子的结构评课ppt课件,文件包含薛课件ppt、超越梦想mp3等2份课件配套教学资源,其中PPT共13页, 欢迎下载使用。













