





高中化学鲁科版 (2019)必修 第二册第2章 化学键 化学反应规律本章综合与测试复习课件ppt
展开
这是一份高中化学鲁科版 (2019)必修 第二册第2章 化学键 化学反应规律本章综合与测试复习课件ppt,共41页。PPT课件主要包含了探究点一,微粒间的作用力,探究点二,原电池中正负极的判断,探究点三,探究点四,化学平衡状态的判断,探究点五,前2min,氢离子浓度大等内容,欢迎下载使用。
化学键 化学反应规律
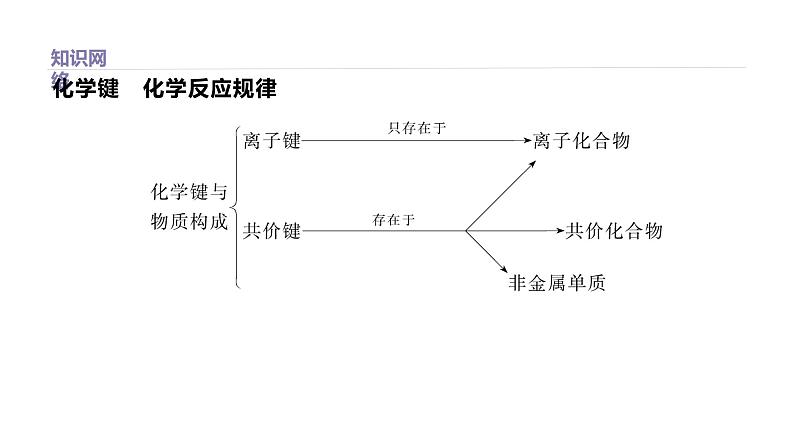
物质类型与化学键类型的关系
例1 人在地球上生活而不能自动脱离地球,是因为地球对人有吸引力。同样的,原子之间能自动结合是因为它们之间存在着强烈的相互作用——化学键,由于有化学键才使得一百多种元素构成了世界万物。关于化学键的下列叙述中,正确的是( )A.离子化合物中可能含共价键,共价化合物中不含离子键B.共价化合物中可能含有离子键,离子化合物中只含离子键C.单质中一定含有共价键D.含有离子键的物质可能是单质
[解析] 本题考查利用化学键对化合物进行分类。解答此题的关键是理解只有离子化合物中才含有离子键,共价键既可存在于共价化合物中,也可存在于离子化合物中。如NaOH是由Na+和OH-结合成的离子化合物,而OH-中含O—H共价键,在
共价化合物中仅存在共价键,不存在离子和离子键,故A项正确,B项错误;稀有气体分子中不存在化学键,C项错误;离子键是阴、阳离子之间的静电作用,含有离子键的物质一定是化合物,D项错误。
[归纳总结] 1.离子化合物中一定有离子键,也可能有共价键,如NH4Cl、Na2SO4。2.共价化合物中只有共价键,一定没有离子键。3.稀有气体是单原子分子,不含化学键;非金属单质中一定只含共价键。4.离子化合物中一般既含金属元素又含非金属元素(铵盐除外);共价化合物中一般只含非金属元素,但只含非金属元素的化合物不一定是共价化合物,如(NH4)2SO4。
[解析] 金属和非金属化合时不一定形成离子键,如AlCl3中的化学键为共价键,故①错;
在离子化合物中,阴、阳离子间存在相互作用,但不单指吸引力,还有排斥力,故②错;
HNO3分子属于共价化合物,分子中不存在离子键,③错;
化学反应的本质是旧键断裂、新键形成的过程,但HCl中存在共价键而非离子键,故④错。
[归纳总结] 化学键概念“六澄清”(1)稀有气体中不含化学键。(2)离子化合物一定含离子键,可能含共价键。(3)共价化合物只含共价键,一定无离子键,含共价键的也可能是非金属单质。(4)含活泼金属元素的化合物不一定是离子化合物,如AlCl3。(5)不含金属元素的化合物可能是离子化合物,如铵盐。(6)化学键被破坏不一定发生化学变化,但化学反应中一定有化学键的断裂和形成。
例3 银锌电池广泛用作各种电子仪器的电源,其电极分别为Ag2O和Zn,电解质溶液为KOH溶液,总反应为Ag2O+Zn+H2O=2Ag+Zn(OH)2,下列说法中不正确的是( )A.原电池放电时,负极上发生反应的物质是ZnB.负极发生的反应是Zn+2OH--2e-=Zn(OH)2C.工作时,负极区溶液酸性增强,正极区碱性增强D.溶液中OH-向正极移动,K+、H+向负极移动
[解析] 根据总反应Ag2O+Zn+H2O= 2Ag+Zn(OH)2,分析其化合价变化可知,Zn在负极上反应,Ag2O在正极上反应,电解质溶液为KOH溶液,所以负极反应式为Zn+2OH--2e-=Zn(OH)2,正极反应式为Ag2O+2e-+H2O=2Ag+ 2OH-。这样,在负极区因OH-被消耗,碱性减弱,pH减小,溶液中OH-作定向移动到负极来补充,正极区生成OH-碱性增强,pH增大,故D项错误。
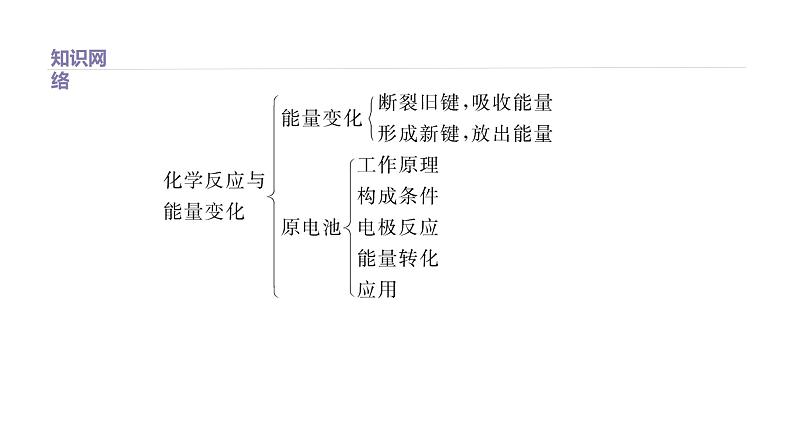
[归纳总结] 原电池两极的判断方法1.根本依据电子流出的一极为负极,电子流入的一极为正极。2.常用方法(1)据电极上发生反应的类型判断,发生氧化反应的电极为负极,发生还原反应的电极为正极。(2)据金属电极活动性的相对强弱判断。一般来说,相对活泼的金属电极为负极,相对不活泼的电极为正极。特别注意该结论的局限性,因为电极判定受电解质
溶液的影响,如镁-铝-盐酸电池中,镁为负极,而镁-铝-氢氧化钠溶液电池中铝为负极,因为镁与NaOH溶液不反应,而铝与NaOH溶液反应。(3)据电池总反应中元素化合价的升降来判断。电池总反应中元素化合价升高的电极材料为负极,元素化合价降低的电极材料为正极。(4)根据电解质溶液中离子迁移方向:阳离子移向原电池正极,阴离子移向原电池负极。
例4 对于反应A2+3B2=2C来说,以下化学反应速率的表示中,反应速率最快的是( )A.v(B2)=0.8 ml·L-1·s-1 B.v(A2)=0.4 ml·L-1·s-1C.v(C)=0.6 ml·L-1·s-1 D.v(B2)=4.2 ml·L-1·s-1
化学反应速率的大小比较
[解析] 反应过程中,混合气体的质量在变化,当混合气体的密度不再变化,由于是在恒容条件下,说明反应已处于平衡状态,A正确;气体系数前后相等,压强是个恒量,B错误;C与D的物质的量相等不能说明浓度不再改变,所以不能说明反应达到平衡状态,C错误;消耗1 ml B的同时生成0.5 ml D均表示正反应速率,所以不能说明反应达到平衡状态,D错误。
1.下列说法正确的是( )①离子化合物一定含离子键,也可能含共价键②共价化合物可能含离子键③含金属元素的化合物不一定是离子化合物④由非金属元素组成的化合物一定是共价化合物⑤由分子组成的物质中一定存在化学键⑥熔融状态能导电的化合物一定是离子化合物A.①③⑤ B.②④⑥ C.②③④ D.①③⑥
[解析] ②共价化合物一定只含共价键,不可能含离子键,含有离子键的化合物一定是离子化合物;④由非金属元素组成的化合物不一定是共价化合物,如NH4Cl等铵盐都是离子化合物;⑤由分子组成的物质中不一定存在化学键,如稀有气体分子。
2.等质量的铁与过量的盐酸在不同的实验条件下进行反应,测定在不同时间t产生氢气体积V的数据,根据数据绘制得到图中曲线,则曲线a、b、c、d所对应的实验组别可能是( )
A.4-3-2-1B.1-2-3-4 C.3-4-2-1 D.1-2-4-3
[解析] 化学反应速率与温度、浓度和固体物质的表面积的大小有关,实验1的盐酸的浓度最小,反应的温度最低,所以化学反应速率最慢;由于实验3的反应温度比
实验2的反应温度高,所以反应速率实验3大于实验2;而实验4和实验3盐酸浓度相同,反应的温度相同,物质的状态不相同,粉末状比块状反应速率快,所以实验4最快。
3.将纯锌片和纯铜片按图所示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是( )A.两烧杯中铜片表面均无气泡产生B.甲中铜片是正极,乙中铜片是负极C.两烧杯中溶液的酸性均减弱D.产生气泡的速率甲比乙慢
[解析] 因乙烧杯中锌片和铜片没有接触,没有构成闭合回路,故不能构成原电池,因此乙装置中铜片上没有气泡,只有锌片上有气泡。因甲烧杯中锌片和铜片用导线连接后构成原电池,加快了锌的溶解,铜片上产生气泡的速率比乙
装置中锌片上产生气泡的速率快。又因两烧杯中的锌都能与稀硫酸反应产生氢气而消耗H+,导致两烧杯中溶液的酸性均减弱。
[解析] 利用化学反应速率之比等于方程式中化学计量数之比可知,A项应为3v逆(N2)=v正(H2),才表示v正=v逆,故A错误;B项均表示正反应速率,无论反应是否处于平衡状态,都成立,B错误;
混合气体密度不变,说明体系中混合气体质量不变,若未达到平衡,则混合气体质量改变,所以C项表示达到 平衡状态;D项表示的浓度关系与是否平衡无关,错误。
5.用纯净的CaCO3与100 mL稀盐酸反应制取CO2,实验过程记录如图所示(CO2的体积已折算为标准状况下的体积),下列分析正确的是( )A.OE段表示的平均反应速率最快B.EF段,用盐酸表示该反应的平均反应速率为0.4 ml·L-1·min-1C.OE、EF、FG三段中,该反应用二氧化碳表示的平均反应速率之比为2∶6∶7D.F点收集到的CO2的量最多
[解析] 根据反应速率的定义,单位时间内生成物生成的多或反应物消耗的多,则速率快。由于横坐标都是1个单位,EF段产生的CO2多,所以该段反应速率最快,不是OE段,A错;
EF段产生的CO2的物质的量共0.02 ml,由于反应中n(HCl)∶n(CO2)=2∶1,所以该段消耗HCl的物质的量为0.04 ml,时间为 1 min,所以用盐酸表示的EF段平均反应速率是 0.4 ml·L-1·min-1,B正确;
由于三段所用时间都是 1 min,所以三段的速率之比就等于产生CO2的体积之比,即224∶(672-224)∶(784-672)=2∶4∶1,C错;收集的CO2是看总量的,F点只有672 mL,G点的体积最大,D错。
6.(1)在25 ℃时,向100 mL含氯化氢14.6 g的氯化氢溶液里放入5.60 g纯铁粉(不考虑反应前后溶液体积的变化),反应开始至2 min末,收集到1.12 L(标准状况)氢气。在此之后,又经过4 min,铁粉完全溶解。则前2 min与后4 min相比,反应速率较快的是 ,其原因是 。
[解析] 由于前2 min反应物的浓度比后4 min的浓度大,所以前2 min的反应速率要大。
(2)在1×105 Pa和25 ℃时,H—H键、N≡N键和N—H键的键能分别为 436 kJ·ml-1、945 kJ·ml-1和391 kJ·ml-1。①根据上述数据判断工业合成氨的反应是 (填“吸热”或“放热”)反应;
[解析]由于工业合成氨的反应是N2+3H2 2NH3,根据所给的各种化学键的键能关系,化学键断裂吸收的能量为945 kJ+3×436 kJ=2253 kJ,而形成化学键放出的能量为6×391 kJ=2346 kJ,放出的能量多于吸收的能量,所以该反应是放热反应。
②在25 ℃时,取1 ml氮气和3 ml氢气放入一密闭容器中,在催化剂存在下进行反应。理论上(完全反应时)放出或吸收的热量为Q1,则Q1为 kJ;
[解析]理论上放出的热量为2346 kJ-2253 kJ=93kJ.
③实际生产中,放出或吸收的热量为Q2,Q1与Q2比较,正确的是 。 A.Q1>Q2 B.Q1 v逆(X),故B正确;在t1时刻,可逆反应已达化学平衡,此时正、逆反应速率相等,故C正确;
在t1时刻达到平衡是因为此时反应混合物中各组分的浓度不再变化,故D错误。
9.某研究小组决定用实验探究的方法证明化学反应具有一定的限度,在一定条件下会达到“平衡状态”。他们设计了如下实验:取5 mL 0.1 ml·L-1 KI溶液于试管中,滴加0.1 ml·L-1 FeCl3溶液2 mL。(1)写出上述实验过程中反应的离子方程式: 。 (2)怎样通过实验说明上述反应的发生? , , 。
取少量反应液,加入少量CCl4,振荡,发现CCl4层显浅紫色,证明萃取到I2,即有I2生成(或取少量反应液,滴加淀粉溶液,若溶液变蓝,则说明生成了I2)
相关课件
这是一份鲁科版 (2019)必修 第二册第1节 化学键与物质构成图文ppt课件,共46页。PPT课件主要包含了内容索引,素养目标,原子离子,电化二元学说,共价键电子对,强相互作用,氢原子和氧原子间,氢原子和氯原子,氮原子和氢原子间,旧化学键断裂等内容,欢迎下载使用。
这是一份鲁科版 (2019)必修 第二册第2章 化学键 化学反应规律第1节 化学键与物质构成说课ppt课件,共41页。PPT课件主要包含了化学键,知识点一,相邻原子,旧化学键的断裂,新化学键的形成,释放能量,吸收能量,离子键和共价键,知识点二,正电荷等内容,欢迎下载使用。
这是一份鲁科版 (2019)必修 第二册第2章 化学键 化学反应规律本章综合与测试复习ppt课件,共32页。PPT课件主要包含了化学键与化学反应,化学反应的快慢与限度等内容,欢迎下载使用。










