




化学必修 第二册第2章 化学键 化学反应规律本章综合与测试复习课件ppt
展开
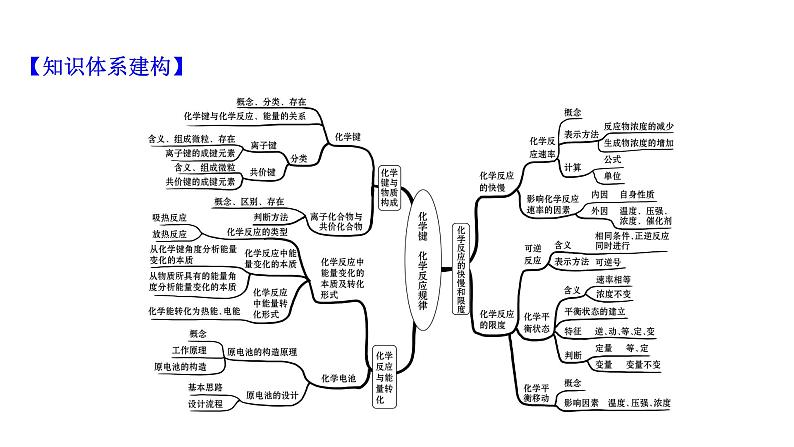
这是一份化学必修 第二册第2章 化学键 化学反应规律本章综合与测试复习课件ppt,共19页。PPT课件主要包含了主题整合·践行素养,知识体系建构,应用实践·提升素养等内容,欢迎下载使用。
以“工业合成氨”为例复习化学键、化学反应中的能量变化及化学反应进行的快慢与限度
【主题互动探究】利用氮气与氢气直接合成氨的工业生产曾是一个较难的课题,1900年,法国化学家勒·夏特列通过理论计算,认为氮气和氢气可以直接化合生成氨。他在实验验证过程中发生了爆炸,一个助手差点丧命。他没有调查事故发生的原因,而是觉得这个实验有危险,就放弃了。同时间,许多著名的法国化学家如泰纳、德维尔乃至贝托洛都在这项工作中失败了。1909年,德国物理化学家哈伯用锇催化剂将氮气与氢气在17.5~20MPa和500~600 ℃下直接合成,反应器出口得到6%的氨。
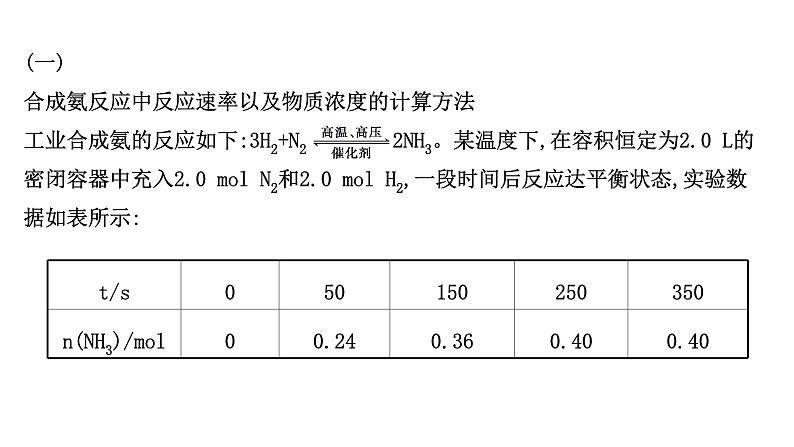
(一)合成氨反应中反应速率以及物质浓度的计算方法工业合成氨的反应如下:3H2+N2 2NH3。某温度下,在容积恒定为2.0 L的密闭容器中充入2.0 ml N2和2.0 ml H2,一段时间后反应达平衡状态,实验数据如表所示:
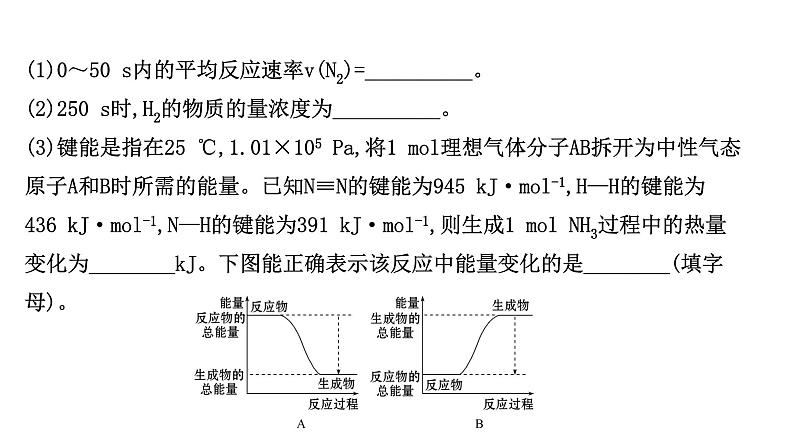
(1)0~50 s内的平均反应速率v(N2)=__________。 (2)250 s时,H2的物质的量浓度为__________。 (3)键能是指在25 ℃,1.01×105 Pa,将1 ml理想气体分子AB拆开为中性气态原子A和B时所需的能量。已知N≡N的键能为945 kJ·ml-1,H—H的键能为436 kJ·ml-1,N—H的键能为391 kJ·ml-1,则生成1 ml NH3过程中的热量变化为________kJ。下图能正确表示该反应中能量变化的是________(填字母)。
(4)为加快反应速率,可以采取的措施是( )A.降低温度B.增大压强C.加入催化剂(5)下列说法错误的是________ 。 A.使用催化剂是为了加快反应速率,提高生产效率B.上述条件下,N2不可能100%转化为NH3C.250~350 s时,生成物浓度保持不变,反应停止
【解析】(1)图表中0~50 s内氨气的浓度变化为0.24 ml,计算氨气的反应速率,速率之比等于化学方程式计量数之比计算得到氮气的反应速率;(2)250 s时,氨气生成的物质的量为0.40 ml,则反应的氢气物质的量=0.6 ml,剩余H2的物质的量为1.4 ml,则H2的物质的量浓度为 =0.7 ml·L-1;(3)根据键能的定义可知反应热=反应物总键能-生成物总键能;依据能量变化判断反应图象变化;(4)降低温度,反应速率减小,故A错误;增大压强,反应速率增大,故B正确;加入催化剂化学反应速率加快,C正确。
(5)使用催化剂是为了加快反应速率,缩短反应达到平衡的时间,提高生产效率,A正确;上述条件下,反应为可逆反应,N2不可能100%转化为NH3 ,B正确;250~350 s生成物浓度保持不变,反应达到平衡状态,反应仍然进行,只是正逆反应速率相同,C错误。答案:(1)1.2×10-3 ml·L-1·s-1(2)0.7 (3)46.5 A (4)B、C (5)C
(二)工业合成氨条件的选择 利用天然气合成氨的工艺流程如图所示:
根据上述流程,完成下列填空:(1)n ml CH4经一次转化后产生CO 0.9n ml、产生H2________ml(用含n的代数式表示)。 (2)K2CO3(aq)和CO2反应在加压下进行,加压的理论依据是________。 A.相似相溶原理B.平衡移动原理C.酸碱中和原理(3)合成氨反应从提高反应速率角度来考虑应选择的条件是________。 A.高温 B.高压C.加入催化剂 D.增加氮气的浓度
【解析】(1)写出化学方程式后很容易看出H2的物质的量;(2)是化学平衡移动原理的应用;(3)对合成氨工业中实际应用的循环操作进行设问和考查。根据外界条件对化学反应速率的影响因素可以判断:若加快反应速率,应该升高温度、增大压强、加入催化剂,并且增大反应物的浓度。答案:(1)2.7n (2)B (3)ABCD
1.一密封体系中发生反应:N2+3H2 2NH3(正反应为放热反应),如图为某一时间段反应速率与反应进程的曲线关系图:
回答下列问题:(1)处于平衡状态的时间段是__________。 (2)t1、t3、t4时刻,体系中分别是什么条件发生了变化?__________、__________、__________。 (3)下列时间段中,氨的百分含量最高的是__________。 A.0~t1 B.t2~t3C.t3~t4D.t5~t6
【解析】本题主要是学会看图,图表达的是速率与时间的关系,只要速率不随时间变化而变化,说明在这条件下反应已经达到平衡了。所以处于平衡状态的时间段是0~t1,t2~t3,t3~t4,t5~t6。从图中可得t1时刻正、逆反应速率都增大,而且v(逆)>v(正),N2+3H2 2NH3(正反应为放热反应),故温度升高,v(逆)>v(正)。图中t3时刻速率增大,而且变化过程中v(逆)=v(正),说明平衡未被打破,所以应该是催化剂导致的。图中t4时刻的变化,v′(逆)、v′(正)都减小且v′(逆)>v′(正),所以改变条件应为减小压强。答案:(1)0~t1,t2~t3,t3~t4,t5~t6(2)温度升高 加入催化剂 减小压强(3)A
2.工业上合成氨的原料之一 ——氢气,有一种来源是石油气,如丙烷。(1)有人设计了以下反应途径(反应方程式未配平),假设反应都能进行,你认为最合理的是________。(已知:CO+H2O CO2+H2) A.C3H8 C+H2B.C3H8 C3H6+H2C.C3H8+H2O CO+H2
(2)按以上最合理的反应途径,理论上用1 ml丙烷最多可制得氨气__________ A.4 ml B.6.7 ml C.10 ml D.2.7 ml(3)该合理的反应途径最显著的优点是______ A.简单易行B.制得的H2纯度高C.制得的H2产量高D.可同时获得大量热量
【解析】(1)要分析得出哪种反应方式生成的H2最多,配平反应的化学方程式如下:A.C3H8 3C+4H2。B.C3H8 C3H6+H2。C.C3H8+3H2O 3CO+7H2,生成的CO又能和H2O反应:CO+H2O CO2+H2。当C3H8均为1 ml时,C选项的途径中产生H2最多。(2)C3H8+3H2O 3CO+7H2,3CO+3H2O 3CO2+3H2N2+3H2 2NH3,由以上反应可得C3H8~10H2,3H2~2NH3。根据相关量,进行计算:C3H8~10H2~ ×2NH3。所以1 ml C3H8最多可制得6.7 ml氨,应选B。
相关课件
这是一份鲁科版 (2019)必修 第二册第1节 化学键与物质构成图文ppt课件,共46页。PPT课件主要包含了内容索引,素养目标,原子离子,电化二元学说,共价键电子对,强相互作用,氢原子和氧原子间,氢原子和氯原子,氮原子和氢原子间,旧化学键断裂等内容,欢迎下载使用。
这是一份鲁科版 (2019)必修 第二册第2章 化学键 化学反应规律第1节 化学键与物质构成说课ppt课件,共41页。PPT课件主要包含了化学键,知识点一,相邻原子,旧化学键的断裂,新化学键的形成,释放能量,吸收能量,离子键和共价键,知识点二,正电荷等内容,欢迎下载使用。
这是一份鲁科版 (2019)必修 第二册第2章 化学键 化学反应规律本章综合与测试复习ppt课件,共32页。PPT课件主要包含了化学键与化学反应,化学反应的快慢与限度等内容,欢迎下载使用。










