




鲁科版 (2019)必修 第二册第3节 元素周期表的应用图文课件ppt
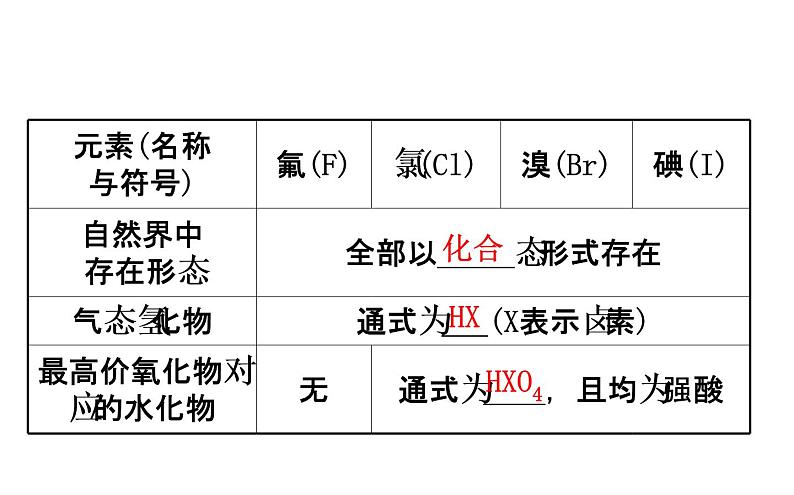
展开一、预测同主族元素的性质1.卤族元素原子结构和性质的相似性与递变性(1)结构、性质的相似性。
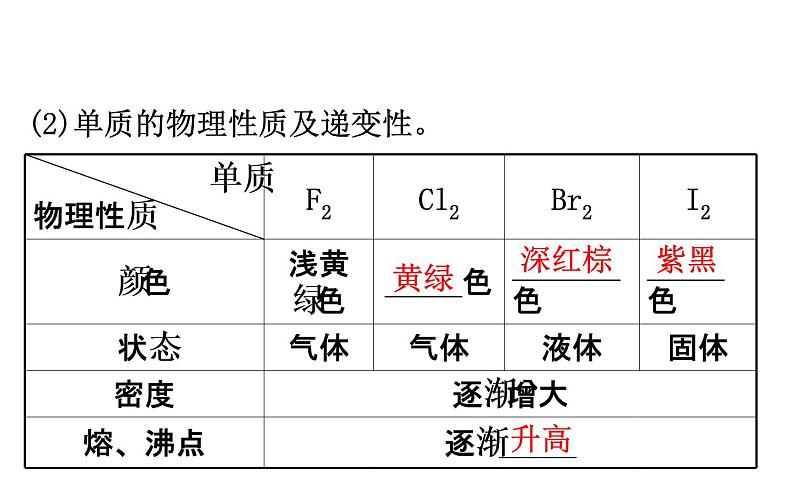
(2)单质的物理性质及递变性。
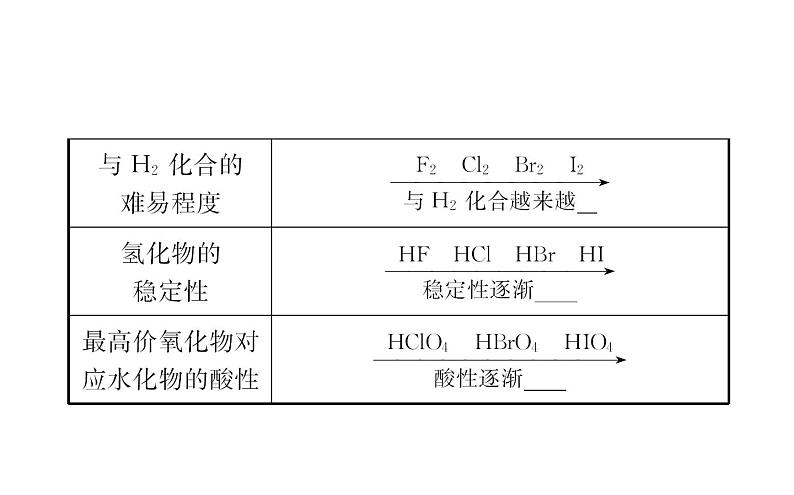
(3)结构及化学性质的递变性。
【巧判断】(1)卤素单质按F2、Cl2、Br2、I2的顺序颜色变浅,密度增大。( )提示:×。卤素单质的颜色是逐渐加深。
(2)HCl、HBr、HI的还原性依次减弱。( )提示:×。HCl、HBr、HI的还原性就是阴离子的还原性,因此逐渐增强。
(3)卤族元素的单质越活泼,其熔点和沸点就越高。( )提示:×。卤族元素从上到下,单质的氧化性逐渐减弱,熔沸点逐渐升高。
2.碱金属元素原子结构和性质的相似性与递变性(1)结构、性质的相似性。
(2)单质及化合物性质的递变性。
【情境·思考】某兴趣小组在实验室中完成了如图所示的实验:
(1)请叙述上述实验现象的异同点。提示:相同点有:金属浮在水面上,熔成闪亮的小球,小球四处游动,发出“嘶嘶”的响声;反应后的溶液呈红色。不同点有:钾与水的反应有轻微爆炸声并着火燃烧。
(2)你从上述实验能得出什么样的结论?提示:通过上述实验可以得出与水反应剧烈程度:K>Na;金属的活泼性:K>Na。
3.同主族元素性质的递变规律
【微思考】 你能说明同主族元素性质相似性和递变性的原因吗?
提示:同主族元素原子的最外层电子数相同,所以同主族元素性质具有相似性。同主族元素原子的电子层数逐渐增多,原子半径增大,所以元素原子失电子能力增强,得电子能力减弱,元素的金属性增强,非金属性减弱。
二、元素周期表的应用1.科学预测根据元素在周期表中的位置,推测元素的原子结构,预测其主要性质,为研究物质结构、发现新元素、合成新物质等提供许多有价值的指导。
2.在生产上的某些应用(1)利用元素周期表寻找新材料。将下面左右两侧对应内容连线:
(2)利用元素周期表指导探矿。地球上化学元素的分布与元素在周期表中的位置密切相关。将下面左右两侧对应内容连线:
【情境·思考】人工合成氨是科学史上的里程碑之一。一百多年来,工业合成氨需要高温高压的苛刻条件,而自然界的生物固氮是在常温常压下进行的。因此高效的人工模拟生物固氮成为催化科学领域的圣杯。
若要研制新型的高效催化剂,应该在元素周期表的什么位置寻找合适的元素?
提示:在元素周期表中的过渡元素部分寻找合适的催化剂。
知识点一 同主族元素结构性质的相似性和递变性1.卤素单质的相似性(用X表示卤族元素)
2.碱金属单质的相似性(用R表示碱金属元素)
3.同主族元素原子结构与性质的递变规律
【易错提醒】碱金属和卤族元素的特殊性(1)碱金属元素的特殊性①因Na、K都是很活泼的金属,易与H2O反应,故不能从溶液中置换出相对不活泼的金属,只有在熔融状态下才能置换出不活泼的金属。②Na、K通常保存在煤油中,Li通常用液体石蜡密封。③Li在O2中燃烧生成Li2O,Na在O2中燃烧生成Na2O2。
(2)卤族元素的特殊性①氟元素无正价,无含氧酸,而氯、溴、碘元素有最高正价和含氧酸。②X2+H2O====HX+HXO(X代表Cl、Br、I),而2F2+2H2O====4HF+O2。
③溴单质在常温下是唯一的一种液态非金属单质。④碘为紫黑色固体,易升华,淀粉遇I2变蓝色。⑤氢氟酸为弱酸,而盐酸、氢溴酸、氢碘酸为强酸。
【思考·讨论】(1)Li、Na、K在空气中燃烧分别生成Li2O、Na2O2、KO2(超氧化钾)说明什么问题?提示:说明Li、Na、K活动性依次增强。
(2)Na、K为什么保存在煤油中?提示:钠、钾保存在煤油中,以避免与空气中的O2、H2O反应。
(3)利用原子结构如何解释F、Cl、Br、I得失电子能力的变化?提示:F、Cl、Br、I最外层都有7个电子,都易得一个电子达到稳定结构,但原子半径依次增大,得电子能力逐渐减弱。
【案例示范】【典例】(2020·潍坊高一检测)X、Y两种元素,原子序数均小于20;X、Y原子的最外层电子数相等,且原子半径X
【解题指南】解答本题时应注意以下几点:(1)同主族元素性质的递变规律;(2)熟悉各主族常见元素的性质,尤其第2、3周期的;(3)注意一些元素的特殊性。
【解析】选A。X、Y原子的最外层电子数相同,且原子序数<20,说明X、Y为同一主族的元素,又X的原子半径小于Y,说明在周期表中X位于Y的上方。A项,若X(OH)n为强碱,则X为金属元素,根据同主族元素性质的递变规律,Y也为金属元素,且Y元素原子的失电子能力要强于X元素原子,Y(OH)n应该比X(OH)n的碱性更
强;B项,若HnXOm为HNO3,氮元素的氢化物NH3溶于水显碱性;C项,若X元素为氧,则Y元素为硫,形成的单质是S;D项,若Y元素为氯,则X元素为氟,氯元素的最高正价为+7价,但氟元素无正价。
【母题追问】(1)若Y能形成H3YO4的化合物,则X也能形成H3XO4的化合物吗?提示:不能。若Y能形成H3YO4的化合物,则X、Y应为第ⅤA族的氮、磷元素,氮元素形成的HNO3。
(2)若Y形成氢化物的水溶液呈酸性,则X形成的氢化物的水溶液也一定呈酸性吗?提示:不一定。若X、Y为第ⅥA族元素,H2S呈酸性,而H2O呈中性。
【情境·迁移】社会生产、科学研究和国防建设等部门,对时间的要求特别高。它们要求时间要准到千分之一秒,甚至百万分之一秒。为了适应这些高精度的要求,人们制造出了一系列精密的计时器具,铯钟就是其中的一种。铯钟又叫“铯原子钟”。
铯属于第6周期的碱金属元素,推测金属铯与水反应的现象,写反应的方程式并判断CsOH的碱性强弱。
提示:金属铯与水能剧烈反应,甚至发生剧烈的爆炸,反应的方程式为2Cs+2H2O====2CsOH+H2↑,CsOH属于强碱。
【知识·巩固】1.(2020·泰安高一检测)砹是原子序数最大的卤族元素,根据卤素性质的递变规律,对砹及其化合物的叙述,正确的是( )A.与H2化合能力:At2>I2
B.砹在常温下为白色固体C.砹原子的最外电子层上有7个电子D.砹能从NaCl溶液中置换出氯单质
【解析】选C。从F2到At2,元素的非金属性逐渐减弱,与H2化合能力逐渐减弱,A项不正确;由F2到I2,单质的颜色依次加深,I2是紫黑色固体,则砹为黑色固体,B项不正确;卤族元素的原子,最外层上都有7个电子,C项正确;因氧化性Cl2>At2,所以At2不能从溶液中置换出Cl2,D项不正确。
2.碱金属钫(Fr)具有放射性,它是碱金属元素中最重的元素,下列对其性质的预言中,错误的是( )A.在碱金属元素中它具有最大的原子半径B.它的氢氧化物化学式为FrOH,是一种极强的碱C.钫在空气中燃烧时,只生成化学式为Fr2O的氧化物D.它能跟水反应生成相应的碱和氢气,由于反应剧烈而发生爆炸
【解析】选C。碱金属中Fr位于第7周期,原子半径最大,故A说法正确;Fr为碱金属,其氢氧化物为FrOH,同主族从上到下最高价氧化物对应水化物碱性增强,即FrOH碱性最强,故B说法正确;Fr的金属性非常强,在空气中燃烧,得到的氧化物非常复杂,故C说法错误;Fr单质金属性是碱金属中最强的,与水反应生成相应的碱和氢气,与水反应非常剧烈,故D说法正确。
3.下列各组比较不正确的是( )A.铯与水的反应现象比钠剧烈B.还原性:K>Na>LiC.熔点:Li>Na>KD.碱性:LiOH>NaOH>KOH
【解析】选D。铯的活动性比钠强,与水反应比钠更剧烈,甚至会爆炸,A项正确;随着电子层数增多,碱金属的金属性逐渐增强,单质的还原性依次增强,即还原性:K>Na>Li,B项正确;碱金属元素从Li到Cs,熔沸点逐渐降低,即Li>Na>K>Rb>Cs,C项正确;从Li到Cs,碱金属元素的金属性逐渐增强,最高价氧化物对应的水化物碱性依次增强,即碱性:LiOH
D.X的氢化物水溶液的酸性一定比Y的氢化物的水溶液的酸性强
【解析】选C。同一主族,自上而下,金属性逐渐增强,非金属性逐渐减弱。不要混淆最高价含氧酸的酸性与氢化物水溶液的酸性,如酸性:HF
应用“位置、结构、性质”三者之间的关系解答问题时要注意以下几个方面:
1.元素的原子结构与元素在周期表中位置的关系
2.原子结构与元素性质的关系
3.元素性质与元素在周期表中位置的关系
【方法规律】元素推断的思路分析
【思考·讨论】(1)什么元素(放射性元素除外)的金属性最强?什么元素的非金属性最强?分别位于元素周期表中的什么位置?提示:铯的金属性最强,氟的非金属性最强,分别位于元素周期表的左下角和右上角。
(2)如果已知X、Y为周期表中相邻的两元素,且它们的最高价氧化物对应水化物的酸性强弱为X>Y,能否确定它们的相对位置?
解析:可根据元素非金属性的变化规律确定它们的相对位置。由已知条件可确定非金属性为X>Y,所以,如果它们同周期,则X在Y的右面;如果它们同主族,则X在Y的上面。
【案例示范】【典例】今年是门捷列夫发现元素周期律150周年。下表是元素周期表的一部分,W、X、Y、Z为短周期主族元素,W与X的最高化合价之和为8。下列说法错误的是( )
A.原子半径:W
【解析】选D。主族元素的最高化合价与最外层电子数相等,由“W与X的最高化合价之和为8”可知,W为N,X为Al,Y为Si,Z为P。原子半径:N
A.原子半径:丙<丁<戊B.金属性:甲>丙C.氢氧化物碱性:丙>丁>戊D.最外层电子数:甲>乙
【解析】选C。同周期元素原子半径从左至右是依次减小的,故A项错误;同主族元素金属性自上而下是增强的,故B项错误;同周期元素的金属性从左至右越来越弱,故对应氢氧化物的碱性是逐渐减弱的,故C项正确;同周期元素的原子最外层电子数从左到右越来越多,故D项错误。
2.W、X、Y、Z四种短周期主族元素在周期表中的相对位置如图所示,由此可知( )
A.Z元素氢化物的水溶液一定是强酸B.原子半径X
元素的非金属性越强,其最高价氧化物的水化物酸性越强,非金属性Y元素最强,若Y是氧、氟元素,其没有最高价氧化物的水化物,故C错误;元素的非金属性越强,其简单氢化物的稳定性越强,这几种元素非金属性最强的是Y元素,所以Y元素的氢化物稳定性最强,故D正确。
3.X、Y、Z均为短周期主族元素,它们原子的最外层电子数之和为10。X与Z同族,Y最外层电子数等于X次外层电子数,且Y原子半径大于Z。下列叙述正确的是( )
A.熔点:X的氧化物比Y的氧化物高B.热稳定性:X的氢化物大于Z的氢化物C.X与Z可形成离子化合物ZXD.Y的单质与Z的单质均能溶于浓硝酸
【解析】选B。X、Y、Z为短周期主族元素,X与Z同族,所以二者最外层电子数相等,Y最外层电子数等于X次外层电子数,由于Y不是稀有气体,最外层电子数不是8,因此Y的最外层电子数为2,三种元素最外层电子数之和为10,可以求出X与Z的最外层电子数为4。结合Y原子半径大于Z,可知X为碳元素,Y为镁元素,Z为硅元素。因为CO、CO2常温下均是气体,MgO是固体,
所以C的氧化物的熔点比Mg的氧化物低,A错误。因为碳元素的非金属性比硅元素强,所以碳的氢化物的热稳定性大于硅的氢化物,B正确。C和Si金属性、非金属性都不强,不易形成阴离子或阳离子,二者形成的化合物是共价化合物,C错误。金属Mg可以与浓硝酸反应而溶解,硅与浓硝酸常温下不反应,D错误。
【补偿训练】元素R、X、T、Z、Q在元素周期表中的相对位置如图所示,其中R单质在暗处与H2剧烈化合并发生爆炸,则下列判断正确的是( )
A.非金属性:Z
高中化学鲁科版 (2019)必修 第二册第1章 原子结构 元素周期律第3节 元素周期表的应用教课ppt课件: 这是一份高中化学鲁科版 (2019)必修 第二册第1章 原子结构 元素周期律第3节 元素周期表的应用教课ppt课件,共60页。PPT课件主要包含了NO1,NO2,NO3等内容,欢迎下载使用。
高中化学鲁科版 (2019)必修 第二册第1章 原子结构 元素周期律第3节 元素周期表的应用背景图课件ppt: 这是一份高中化学鲁科版 (2019)必修 第二册第1章 原子结构 元素周期律第3节 元素周期表的应用背景图课件ppt,共42页。PPT课件主要包含了知识铺垫,新知预习,自主测试,任务一,任务二,素养脉络,随堂检测等内容,欢迎下载使用。
高中第1节 原子结构与元素性质授课课件ppt: 这是一份高中第1节 原子结构与元素性质授课课件ppt,共60页。PPT课件主要包含了必备知识·自主学习,电子层,核外电子排布规律,NaOH+H2↑,Mg+2H2O,KOH+H2↑,KNaMg,判断依据,失电子,得电子等内容,欢迎下载使用。













