


化学必修 第二册第3节 元素周期表的应用示范课ppt课件
展开
这是一份化学必修 第二册第3节 元素周期表的应用示范课ppt课件,共60页。PPT课件主要包含了必备知识·自主学习,b与酸反应,②置换氢气,点燃或光照,逐渐增强,逐渐减弱,关键能力·合作学习,课堂小结,课堂检测·素养达标等内容,欢迎下载使用。
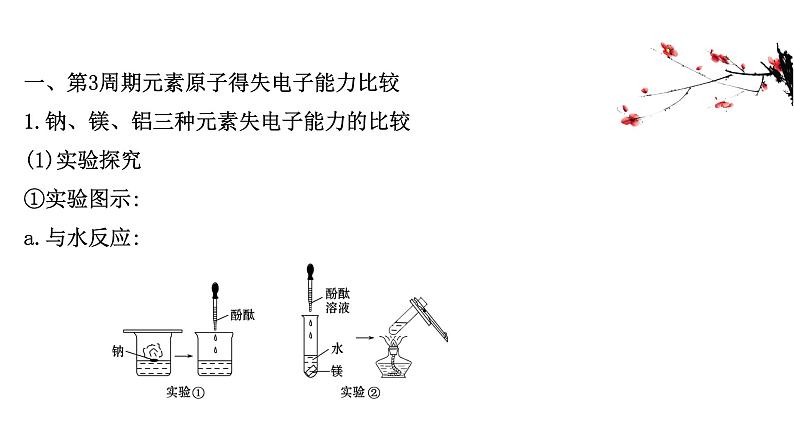
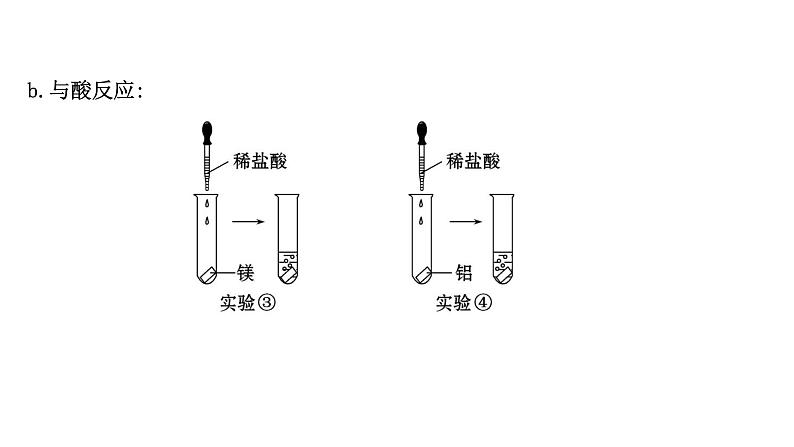
一、第3周期元素原子得失电子能力比较1.钠、镁、铝三种元素失电子能力的比较(1)实验探究①实验图示:a.与水反应:
③镁、铝氢氧化物性质的比较(用化学方程式表示)。a.MgCl2溶液中加入NaOH溶液:________________________________。b.AlCl3溶液中逐滴加入NaOH溶液:________________________________;______________________________;
MgCl2+2NaOH ==== Mg(OH)2↓+2NaCl
AlCl3+3NaOH ==== Al(OH)3↓+3NaCl
Al(OH)3+NaOH ==== Na[Al(OH)4]
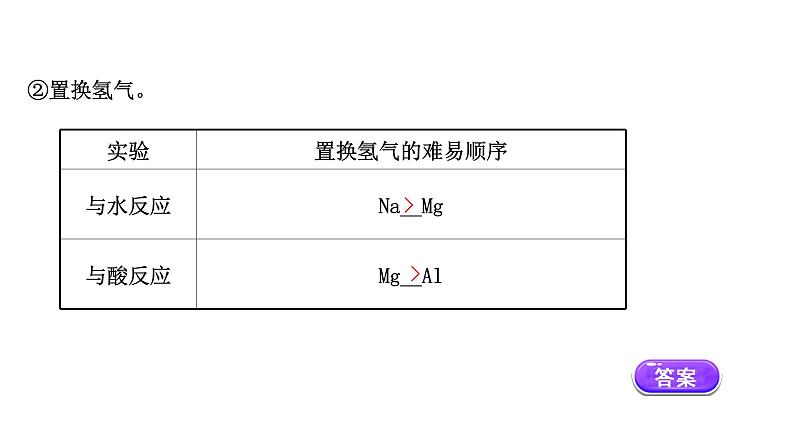
离子方程式:_______________________;__________________________。 Al(OH)3具有两性,既能与碱反应,也能与酸反应,如与盐酸反应:____________________________;离子方程式:_________________________。结论:碱性强弱顺序为_______________。(2)钠、镁、铝失电子能力的比较钠、镁、铝失电子能力由强到弱的顺序依次为Na>Mg>Al。
Al3++3OH- ==== Al(OH)3↓
Al(OH)3+OH- ==== [Al(OH)4]-
Al(OH)3+3HCl ==== AlCl3+3H2O
Al(OH)3+3H+ ==== Al3++3H2O
Mg(OH)2>Al(OH)3
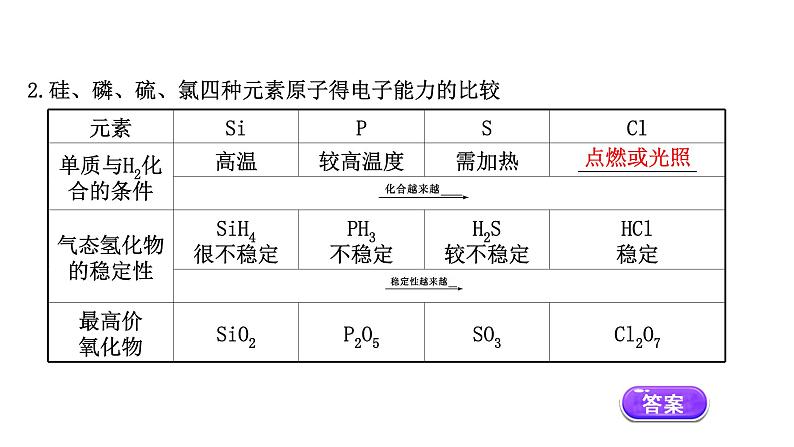
2.硅、磷、硫、氯四种元素原子得电子能力的比较
【自主探索】1.判断下列说法是否正确。(1)碱性:NaOH>Mg(OH)2>Al(OH)3,故还原性:Na>Mg>Al。( )提示:√。由最高价氧化物的碱性NaOH>Mg(OH)2>Al(OH)3,可以得出失电子能力Na>Mg>Al。
(2)熔点、硬度:Al>Na,故金属性:Na>Al。( )提示:×。熔点、硬度属于物理性质,而金属性属于化学性质,二者没有必然的联系。
(3)同一周期元素的原子,半径越小越容易失去电子。( )提示:×。原子半径越小,原子核对外层电子的吸引力越大,越不容易失去电子。
2.(教材二次开发)教材中“硫酸是一种强酸”,则能否由H2SO4的酸性大于HClO的酸性,可推断S的非金属性大于Cl的非金属性?提示:不能。因为HClO不是Cl元素最高价氧化物对应的水化物,无法判断两者的非金属性强弱。
3.(情境思考)铁在氯气中燃烧生成FeCl3,铁粉与硫粉反应生成FeS,请从原子结构角度解释原因。提示:由于S和Cl位于同一周期,电子层数相同,原子半径r(Cl)H2Y>ZH3C.酸性:H3ZO4Z
【思维建模】解此类题的常用思路为
【解析】选B。同一短周期三种元素X、Y、Z,其气态氢化物分别是HX、H2Y、ZH3,则在元素周期表中从左到右依次为Z、Y、X。因为同周期从左到右元素非金属性增强,所以非金属性:X>Y>Z;非金属性越强,气态氢化物越稳定,故热稳定性:HX>H2Y>ZH3;非金属性越强,气态氢化物越不易失电子,还原性越弱,故还原性:HXX-。由于三种元素在元素周期表中从左到右依次为Z、Y、X,它们的非金属性逐渐增强,对应离子的还原性逐渐减弱。
【素养训练】(2020·黄冈高一检测)已知X、Y是第3周期的两种金属元素,且X的原子半径比Y的原子半径大,则下列叙述正确的是( )A.Y的原子序数比X的原子序数小B.X的离子比Y的离子得电子能力强C.X的失电子能力比Y的失电子能力强D.X的离子半径比Y的离子半径小
【解析】选C。X、Y是第3周期的两种金属元素,且X的原子半径比Y的原子半径大,所以Y的原子序数比X的原子序数大;根据同周期元素金属性的变化规律可知,X的失电子能力大于Y,则X的离子比Y的离子得电子能力弱;X的离子和Y的离子具有相同的电子层结构,但X的核电荷数小于Y,所以X的离子半径大于Y的离子半径。
【加固训练】1.X、Y为同一周期的元素,如果X的原子半径大于Y的原子半径,则下列说法不正确的是( )A.若X、Y均为金属元素,则X的金属性强于YB.若X、Y均为金属元素,则X的阳离子的氧化性比Y的阳离子的氧化性强C.若X、Y均为非金属元素,则Y的气态氢化物比X的气态氢化物稳定D.若X、Y均为非金属元素,则Y的最高价含氧酸的酸性强于X的最高价含氧酸的酸性
【解析】选B。X、Y为同一周期元素,X的原子半径大于Y的原子半径,则X的原子序数小于Y的原子序数,即Y在X的右边。依据同周期元素的性质递变规律知,若X、Y均为金属元素,从X到Y,金属性逐渐减弱,元素原子的还原性逐渐减弱,其形成的阳离子氧化性增强,A项正确,B项错误;若X、Y均为非金属元素,同周期元素的非金属性逐渐增强,气态氢化物的稳定性及最高价含氧酸的酸性也逐渐增强,C、D项均正确。
2.门捷列夫经过多年的艰苦探索发现了自然界中一个极其重要的规律——元素周期律。这个规律的发现是继原子-分子论之后,近代化学史上的又一座光彩夺目的里程碑。根据提供的条件推断元素,并按要求填空:
(1)已知某元素原子核外有3个电子层,其最外层电子数为7,最高价氧化物的化学式是什么?最高价氧化物对应水化物的化学式是什么?写出其最高价氧化物对应的水化物与NaOH反应的化学方程式。(证据推理与模型认知)提示:原子核外有3个电子层,其最外层电子数为7,是第3周期ⅦA族的Cl,所以最高价氧化物的化学式是Cl2O7,最高价氧化物对应的水化物是HClO4,与NaOH反应的化学方程式是HClO4+NaOH ==== NaClO4+H2O。
(2)第3周期元素,其最外层电子数与电子层数相同。该元素最高价氧化物的化学式是什么?写出最高价氧化物对应水化物与强碱反应的离子方程式。(宏观辨识与微观探析)提示:第3周期中最外层电子数等于电子层数的是Al,所以最高价氧化物的化学式是Al2O3,其对应的水化物与强碱反应的离子方程式是Al(OH)3+OH- ==== [Al(OH)4]-。
(3)原子序数依次递增的同周期四种元素,它们氢化物的质子数与电子数都与Ar相同,这些氢化物的化学式分别是什么?(证据推理与模型认知)提示:质子数与电子数都与Ar相同的氢化物的化学式分别是SiH4、PH3、H2S、HCl。
(4)某元素的最高正价与最低负价的代数和为4,且最高价氧化物中含氧质量分数为60%。则该元素最高价氧化物的化学式是什么?(科学探究与创新意识)提示:最高正价与最低负价的代数和为4的是ⅥA族的元素,所以其最高价氧化物的化学式是XO3,由于其含氧量为60%,则可以计算得到元素为硫,则其最高价氧化物的化学式是SO3。
知识点二 元素原子得失电子能力的判断依据 1.金属性强弱的判断(1)据元素周期表判断。①同一周期,从左到右:元素的金属性逐渐减弱。②同一主族,从上到下:元素的金属性逐渐增强。(2)据金属活动性顺序判断。
(3)据单质及其化合物的性质判断。①金属单质与水或酸反应越剧烈,元素的金属性越强。②最高价氧化物的水化物的碱性越强,元素的金属性越强。(4)金属单质间的置换反应:较活泼的金属将较不活泼的金属从其盐溶液中置换出来:如Zn+Cu2+ ==== Zn2++Cu,则金属性:Zn>Cu(但活泼金属与水反应剧烈,在水溶液中不能置换出其他金属单质)。(5)据离子的氧化性强弱判断:金属阳离子的氧化性越强,元素的金属性越弱。如氧化性:Cu2+>Fe2+,则金属性:CuBr。(4)据离子的还原性强弱判断:非金属阴离子的还原性越强,元素的非金属性越弱。如还原性:Cl-I。
【易错提醒】正确理解元素的金属性和非金属性(1)元素金属性、非金属性的强弱与元素原子失去或得到电子的难易程度有关,与失去或得到电子的数目无关。如Na在反应中易失去1个电子,Al在反应中易失去3个电子,但金属性:Na>Al。(2)不能理解为某元素的金属性越强,则非金属性越弱。例:Na金属性很强,Na没有非金属性;F非金属性强,它没有金属性。(3)通常根据最高价氧化物对应水化物的酸性或碱性的强弱判断元素非金属性或金属性的强弱,而不是根据其他化合物酸性或碱性的强弱来判断。(4)不能认为失电子难的原子得电子能力一定强。例:He既难失电子,也难得电子。
【合作探究】(1)(思维升华)已知H2S+Cl2 ==== S↓+2HCl,4NH3+3O2 ==== 2N2+6H2O,据此能否确定N和O、S和Cl的非金属性强弱?(证据推理与模型认知)提示:能。H2S+Cl2 ==== S↓+2HCl说明单质的氧化性Cl2>S;4NH3+3O2 ==== 2N2+6H2O说明单质的氧化性O2>N2,故非金属性Cl>S,O>N。
(2)(情境思考)某兴趣小组同学做了如图实验:实验中能观察到什么现象?能否通过该实验证明氯的非金属性比硫强呢?提示:试管内有浅黄色沉淀生成;能,由于Cl2置换出了单质硫,说明Cl2的氧化性大于S,即氯的非金属性比硫强。
(3)(教材二次开发)教材中描述“一般来说,一种元素最高价氧化物对应水化物的酸性越强,表明这种元素原子得电子的能力越强”,则通过如图所示实验可证明元素的原子得电子能力Cl>C>Si吗?(科学探究与创新意识)提示:不能。比较非金属的强弱通常用最高价氧化物对应的水化物的酸性判断。盐酸不是氯元素的最高价含氧酸,故不能根据此实验证明非金属性Cl>C>Si。
【典例示范】【典例】硫、氯及其化合物对环境有着重要的影响,在化工生产和日常生活中的用途也十分广泛,如用作漂白剂、沉淀剂、农药、化肥等。
下列不能说明氯的得电子能力比硫强的事实是( )①HCl比H2S稳定;②HClO氧化性比H2SO4强;③HClO4酸性比H2SO4强;④Cl2能与H2S反应生成S;⑤氯原子最外层有7个电子,硫原子最外层有6个电子;⑥Cl2与Fe反应生成FeCl3,S与Fe反应生成FeS。 A.②⑤B.①②C.①②④D.①③⑤
【解析】选A。气态氢化物稳定性越高,非金属性越强,故①可以说明;只有最高价氧化物对应的水化物酸性越强,则非金属性才越强,故②不能说明,③可以说明;Cl2能置换出H2S中的S,故④可以说明;最外层电子数的多少不能说明非金属性的强弱,故⑤不能说明;⑥中Fe与Cl2、S分别反应生成FeCl3、FeS,说明非金属性Cl>S。综上所述,②⑤不能说明氯的得电子能力比硫强的事实。
【素养训练】同周期主族元素的原子从左到右失电子能力逐渐减弱。某研究性学习小组为了用实验的方法验证镁和铝的失电子能力强弱,学生甲和学生乙分别设计了两种不同的方案。方案一:学生甲用水作试剂,比较镁和铝与水反应的情况方案二:学生乙用稀盐酸作试剂,比较镁和铝与稀盐酸反应的情况
回答下列问题:(1)上述两个实验方案中实验现象较为明显的是方案__________________。 (2)学生乙在实验时取了一段黑色的镁带投入稀盐酸中,现象并不明显,请分析原因:________________________。 (3)学生丙用镁、铝的可溶性盐溶液及一些其他化学试剂进行实验也得出了正确结论,简述学生丙采用的方法:________________________。
【解析】(1)由于金属镁、铝与盐酸反应较快,所以方案二现象较明显。(2)镁表面有氧化物薄膜,使反应现象不明显。(3)Al(OH)3能溶于强碱而Mg(OH)2不能,说明Al(OH)3是两性氢氧化物,故氢氧化铝的碱性比氢氧化镁弱,则铝的失电子能力比镁弱。答案:(1)二 (2)未除去镁表面的氧化膜(3)取氢氧化钠溶液将其分别逐滴加入镁、铝的可溶性盐溶液中,均产生白色沉淀,当加入的NaOH溶液过量时,可使生成的Al(OH)3溶解,而Mg(OH)2不溶
【加固训练】1.能证明Al的金属性比Mg弱的实验事实是( )A.Al的导电性比Mg强B.Al的原子半径比Mg小C.Al(OH)3能溶于NaOH溶液,而Mg(OH)2则不能D.Mg(OH)2的溶解度比Al(OH)3的溶解度略大【解析】选C。元素的金属性是指元素原子的失电子能力。金属的导电性、溶解度与元素的金属性强弱无关;原子半径大小不能作为判断元素金属性强弱的依据。
2.(2020·南昌高一检测)下列关于元素原子得失电子能力的理解不正确的是 ( )A.第3周期由金属元素和非金属元素构成,Na只能失电子,Cl只能得电子B.第3周期主族元素,随着核电荷数的增加,原子得电子能力逐渐增强C.SiH4、PH3、H2S、HCl的稳定性逐渐增强,说明Si、P、S、Cl的得电子能力逐渐增强D.H2SiO3、H3PO4、H2SO4、HClO4的酸性逐渐增强,说明Si、P、S、Cl的得电子能力逐渐增强
【解析】选A。Cl2中的Cl既能得电子,又能失电子,A错误;同周期主族元素从左到右,原子得电子能力逐渐增强,B正确;氢化物的稳定性和最高价氧化物对应水化物的酸性强弱均能作为元素非金属性强弱的判断标准,C、D正确。
【三言两语话重点】 同周期元素,随着核电荷数的递增顺序:(1)原子失电子能力逐渐减弱,得电子能力逐渐增强。(2)元素最高价氧化物对应水化物的酸性逐渐增强,碱性逐渐减弱。(3)气态氢化物的稳定性逐渐增强,还原性逐渐减弱。(4)阳离子的氧化性逐渐增强,阴离子的还原性逐渐减弱。
1.(2020·银川高一检测)下列说法错误的是( )A.Na与Al为同周期元素,钠原子最外层有1个电子,铝原子最外层有3个电子,所以钠的金属性比铝强B.Na与Mg为同周期元素,且Mg的核电荷数比Na的大,所以钠的金属性比镁强C.NaOH为强碱,而Al(OH)3具有两性,所以钠的金属性比铝强D.Zn+2Fe3+ ==== Zn2++2Fe2+,所以Zn的金属性比Fe强【解析】选D。Zn+Fe2+ ==== Zn2++Fe才能说明金属性:Zn>Fe。
2.(2020·成都高一检测)同一短周期的元素W、X、Y、Z的原子序数依次增大,下列叙述正确的是( )A.单质的化学活泼性:WNa+>Mg2+
【加固训练】(改编)下面是某科学兴趣小组的同学做同周期元素性质递变规律的实验时,设计的一套实验方案。实验步骤如下:
请整理并完成实验报告。(1)实验目的: ________________。 (2)实验用品:①试剂:金属钠、镁条、铝条、稀盐酸、新制氯水、新制Na2S溶液、AlCl3溶液、NaOH溶液等。②仪器:________,________,________,试管夹,镊子,小刀,玻璃片,砂纸等。
(3)实验内容:(完成下列表格中的实验现象和化学方程式)(4)实验结论:________________。 (5)请用原子结构的知识简单解释上述结论:________________。
【解析】该小组同学使用的试剂是第3周期的单质或化合物,且利用①和③、④和⑤比较出钠、镁、铝三者从水或盐酸中置换出氢气的难易,进而推出三者的金属性强弱,而通过⑥可得出Al(OH)3具有两性的结论;通过②的置换反应可以得出氯的非金属性比硫强的结论。所以该实验的目的是研究同周期元素性质的递变规律。同周期元素性质的变化规律是由其原子的核外电子排布的变化造成的,同周期的元素原子电子层数相同,核电荷数逐渐增大,原子半径逐渐减小,原子核对核外电子的作用力逐渐增强,失电子能力减弱,得电子能力增强。答案:(1)探究同周期元素性质的递变规律(2)②试管 酒精灯 胶头滴管(合理即可)
相关课件
这是一份高中化学鲁科版 (2019)必修 第二册第3节 元素周期表的应用备课课件ppt,共60页。PPT课件主要包含了必备知识·自主学习,非金属,2性质预测,CO2,SiF4,SiF4↑+2H2↑,SiO2,CaSiO3,Si粗+2CO↑,SiF4↑+2H2O等内容,欢迎下载使用。
这是一份鲁科版 (2019)必修 第二册第3节 元素周期表的应用课文内容ppt课件,共60页。PPT课件主要包含了必备知识·自主学习,逐渐增多,逐渐增大,化合态,HClO4,HBrO4,HIO4,HCl,HBr,深红棕等内容,欢迎下载使用。
这是一份化学必修 第二册第3节 元素周期表的应用备课课件ppt,共37页。PPT课件主要包含了硅及其化合物的性质,知识点一,绝缘体,二氧化硅,+4价,氧化性,无机非金属,石英SiO2,石灰石CaCO3,元素周期表的应用等内容,欢迎下载使用。










