






高中化学鲁科版 (2019)必修 第二册第1节 原子结构与元素性质示范课课件ppt
展开2.钠元素原子结构示意图为 ,钠原子易失去最外层的1个电子形成8电子稳定结构,故钠在化合物中显示+1价。3.元素的化学性质由原子的最外层电子数决定,元素种类由质子数决定。
一、核外电子的分层排布1.核外电子的分层排布(1)在含有多个电子的原子里,能量低的电子通常在离核较近的区域内运动,能量高的电子通常在离核较远的区域内运动。(2)原子核外共有7个电子层,这些电子层由内向外依次称为K电子层、L电子层、M电子层、N电子层……2.核外电子排布的规律
二、核外电子排布的表示方法——结构示意图
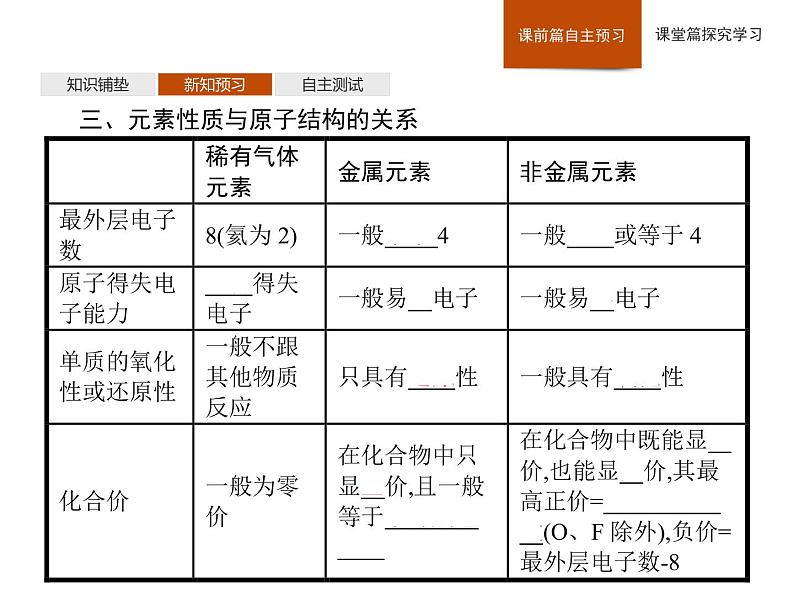
三、元素性质与原子结构的关系
【微思考1】核外电子排布相同的微粒化学性质一定相同吗?提示:核外电子排布相同的微粒化学性质不一定相同,如同位素的化学性质几乎完全相同,但Na+、Ne、F-、Mg2+的化学性质均不同。【微思考2】原子最外层电子数为1的元素是否一定为金属元素?提示:不一定。如氢原子最外层只有1个电子。
1.下列叙述中,正确的是( )A.在多电子的原子里,能量高的电子通常在离核近的区域内运动B.核外电子总是先排在能量低的电子层上,例如只有排满了L层后才排M层C.两种微粒,若核外电子排布完全相同,则其化学性质一定相同D.微粒的最外电子层只有达到8个电子才稳定答案:B解析:在多电子的原子里,能量高的电子通常在离核远的区域内运动,故A项错误;核外电子总是先排在能量低的电子层里,例如一般先排满了L层后才排M层,故B项正确;两种微粒,若核外电子排布完全相同,其性质不一定相同,如Na+和Ne核外都有10个电子,电子排布相同,但是二者性质不同,故C项错误;通常认为最外层有8个电子的结构是一种稳定结构,最外层是第一电子层时有2个电子即为稳定结构,故D项错误。
2.下图为几种粒子的结构示意图,填写以下空白。
(1)属于阴离子结构的粒子是 (填编号,下同)。 (2)形成物质种数最多的元素的原子是 。 (3)对应单质常温下能与水发生反应的微粒是 。 (4)某元素R形成的氧化物为R2O3,则R的离子结构示意图可能是 。 答案:(1)② (2)① (3)②③⑦ (4)⑤
对核外电子排布规律的理解问题探究 M层最多可容纳18个电子,为什么钾原子的核外电子排布不是
提示:(1)核外电子排布规律是相互联系的,不能孤立地应用其中的一项。当M层不是最外层时,最多可以排布18个电子,而当M层是最外层时,最多可以排布8个电子。(2)电子不一定排满M层才排N层,如K和Ca两种原子的核外电子排布情况分别为
知识归纳1.核外电子排布规律(1)“一低”——电子首先排布在能量最低的电子层里,排满能量最低的电子层后,再排布在能量较高的电子层。(2)
2.1~18号元素原子的结构特点
②原子最外层有1个电子的元素:H、Li、Na。③原子最外层有2个电子的元素:Be、Mg、He。④原子最外层电子数等于次外层电子数的元素:Be、Ar。⑤原子最外层电子数是次外层电子数2倍的元素:C。原子最外层电子数是次外层电子数3倍的元素:O。原子最外层电子数是次外层电子数4倍的元素:Ne。⑥原子的电子层数与最外层电子数相等的元素:H、Be、Al。⑦原子的电子总数为最外层电子数2倍的元素:Be。⑧原子次外层电子数是最外层电子数2倍的元素:Li、Si。⑨原子内层电子数是最外层电子数2倍的元素:Li、P。
典例剖析例1核电荷数小于18的某元素X,其原子核外的电子层数为n,最外层电子数为(2n+1),原子核内质子数是(2n2-1),则下列有关X的说法不正确的是( )A.最高正价为+3价B.其最低负价可能为-1价C.氢化物易溶于水D.是活泼的非金属元素
答案:A解析:核电荷数小于18的某元素X,其原子的电子层数为n,最外层电子数为2n+1,原子核内质子数是2n2-1。若n=1时,最外层电子数为3,不符合题意;若n=2时,最外层电子数为5,质子数为7,符合题意;若n=3时,最外层电子数为7,质子数为17,符合题意;由于元素X可能为氮元素或氯元素,最高正价不可能为+3价,A项错误;若元素X为氯元素,其最低负价为-1价,B项正确;元素X可能为氮元素或氯元素,其对应氢化物氨气和氯化氢均易溶于水,C项正确;不管元素X是氮元素还是氯元素,二者均为活泼的非金属元素,D项正确。
变式训练1-1A、B两种原子,A原子L层比B原子M层少3个电子,B原子L层电子数恰为A原子L层电子数的2倍,则A、B分别是( )A.硅和钠B.硼和氮C.碳和氯D.碳和铝答案:C解析:A原子L层比B原子M层少3个电子,则B原子L层一定有8个电子;B原子L层电子数恰为A原子L层电子数的2倍,则A原子L层一定有4个电子,所以A为碳原子。B原子M层有7个电子,则B是氯原子,故C项正确。
变式训练1-2下列关于核外电子排布的说法不正确的是( )A.第n电子层最多可容纳的电子数为2n2B.次外层中最多可容纳的电子数为18C.最多可容纳2个电子的电子层一定是第一电子层D.最多可容纳8个电子的电子层一定是第二电子层答案:D解析:根据核外电子排布规律可知,第n电子层最多可容纳的电子数为2n2,A项正确;次外层中最多可容纳的电子数为18,B项正确;最多可容纳2个电子的电子层一定是第一电子层,即K层,C项正确;由于最外层电子数不超过8个,因此最多可容纳8个电子的电子层不一定是第二电子层,D项错误。
推断10电子微粒、18电子微粒的方法问题探究根据以下两个实验回答相关问题。
(1)请你写出甲实验中反应的化学方程式和离子方程式,并找出其中的10电子微粒。(2)试写出乙实验中反应的离子方程式,并找出其中的18电子微粒。
提示:(1)2Na+2H2O=2NaOH+H2↑,2Na+2H2O=2Na++2OH-+H2↑。Na+、OH-和H2O。(2)H++S2-=HS-、HS-+H+=H2S↑;S2-、Cl-、HS-和H2S。
知识归纳1.常见的10电子微粒
2.常见的18电子微粒
典例剖析例2通常情况下,微粒A、B为分子,C、E为阳离子,D为阴离子,它们都含有10个电子;B溶于A后所得的物质可电离出C、D;A、B、E三种微粒反应后可得C和一种白色沉淀。请回答:(1)用化学符号表示下列4种微粒:A 、B 、C 、D 。 (2)写出A、B、E三种微粒反应的离子方程式: 。
解析:常见的10电子的分子有Ne、HF、H2O、NH3、CH4,B溶于A后能电离出10电子的两种离子,则B为NH3,A为H2O,C为N ,D为OH-。因A、B、E三种微粒反应后可得C和一种白色沉淀,则E可能为Mg2+或Al3+。
寻找10电子微粒和18电子微粒的思维模型(1)10电子微粒的推断方法。
(2)18电子微粒的推断方法。
变式训练2-1下列关于指定粒子构成的几种描述不正确的是( )
变式训练2-2用A+、B-、C2-、D、E、F、G分别表示含有18个电子的七种微粒(离子或分子),请回答:(1)A元素是 、B元素是 、C元素是 (用元素符号表示)。 (2)D是由两种元素组成的双原子分子,其分子式是 。 (3)E是所有含18个电子的微粒中氧化能力最强的分子,其分子式是 。 (4)F是由两种元素组成的三原子分子,其分子式是 。 (5)G分子中含有4个原子,其分子式为 。 答案:(1)K Cl S (2)HCl (3)F2 (4)H2S(5)H2O2或PH3
解析:(1)A+、B-、C2-、D、E、F、G分别表示含有18个电子的七种微粒,则A是K,B是Cl,C是S。(2)D是由两种元素组成的双原子分子,则其分子式为HCl。(3)E是所有含18个电子的微粒中氧化能力最强的分子,则其分子式为F2。(4)F是由两种元素组成的三原子分子,则F是H2S。(5)G分子中含有4个原子,则该物质是H2O2或PH3。
1.某微粒的结构示意图为 ,当x-y=10时,该微粒为( )A.原子B.阳离子C.阴离子 D.无法判断答案:A解析:x-y恰好是最内层和次外层的电子数之和,这说明该微粒是原子。
2.下列说法正确的是( )A.在多电子的原子里,能量高的电子通常在离核近的区域内运动B.任何元素的原子都是由核外电子、核内中子及质子组成的
D.核素指一种原子,而元素是指一类原子答案:D解析:在多电子的原子里,能量高的电子通常在离核远的区域内运动,故A项错误;普通氢原子不含中子,故B项错
的质子数不相同,所以它们不是同位素,故C项错误;核素指一种原子,而元素是指质子数相同的一类原子,故D项正确。
3.(双选)核电荷数为1~18的元素中,下列叙述正确的是 ( )A.最外层只有1个电子的元素不一定是金属元素B.最外层只有2个电子的元素一定是金属元素C.原子核外各层电子数相等的元素是非金属元素D.最外层电子数是次外层电子数的3倍的元素是非金属元素答案:AD解析:最外层只有一个电子的元素不一定是金属元素,如氢元素属于非金属元素,故A项正确;最外层有两个电子的元素不一定是金属元素,如氦元素最外层有两个电子,但氦元素属于非金属元素,故B项错误;原子核外各层电子数相等的元素不一定是非金属元素,如铍元素的原子有两个电子层,每层上都是2个电子,但铍元素是金属元素,故C项错误;最外层电子数是次外层电子数的3倍的元素是氧元素,氧元素属于非金属元素,故D项正确。
4.下列关于原子结构及微粒间的数量关系的说法不正确的是( )A.同种元素的原子均有相同的质子数和中子数
D.核外电子排布相同的微粒化学性质可能相同答案:A解析:同种元素的原子具有相同的质子数,可能含有不同的中子数,如互为同位素的原子,故A项错误;Na+、Mg2+、O2-核外电子层结构相同,故B项正确;铝元素的原子序数是13,因此Al3+的核外电子数为13-3=10,故C项正确;核外电子排布相同的微粒,可能属于同一种元素,化学性质可能相同,故D项正确。
鲁科版 (2019)选择性必修2第2节 原子结构与元素周期表教案配套ppt课件: 这是一份鲁科版 (2019)选择性必修2第2节 原子结构与元素周期表教案配套ppt课件,共60页。PPT课件主要包含了课前自主学习,右上角,电子数目,s22s1,全充满,半充满,课堂合作探究,课堂素养达标等内容,欢迎下载使用。
鲁科版 (2019)选择性必修2第1节 原子结构模型课文内容课件ppt: 这是一份鲁科版 (2019)选择性必修2第1节 原子结构模型课文内容课件ppt,共36页。PPT课件主要包含了学习目标导航,任务分项突破,学科素养测评,课堂小结提升,由近及远,由高到低,核外电子排布规律,归纳拓展,110e-微粒,218e-微粒等内容,欢迎下载使用。
化学必修 第二册第1节 原子结构与元素性质教案配套课件ppt: 这是一份化学必修 第二册第1节 原子结构与元素性质教案配套课件ppt,PPT课件主要包含了点击右图进入等内容,欢迎下载使用。













