





高中化学人教版 (2019)选择性必修1第三章 水溶液中的离子反应与平衡第三节 盐类的水解教课课件ppt
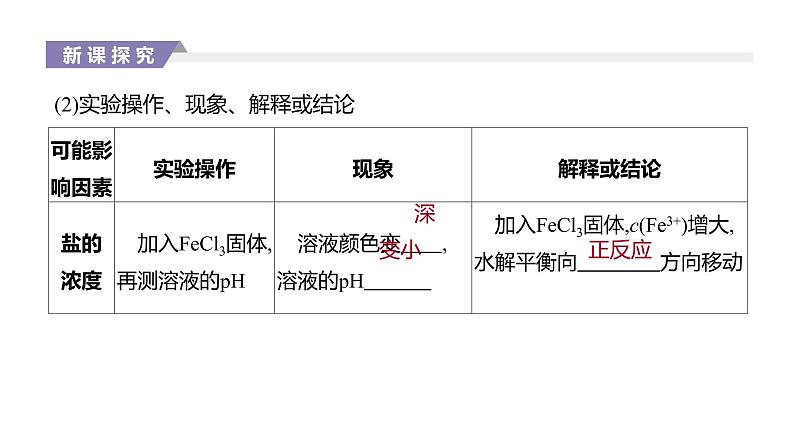
展开(2)实验操作、现象、解释或结论
2.影响盐类水解平衡的因素(1)内因:盐本身的性质。组成盐的弱酸根阴离子相对应的酸越弱(或弱碱阳离子对应的碱越弱),水解程度就 。 (2)外因:受温度、浓度及外加酸碱等因素的影响。①温度:升高温度,盐类水解程度 ,因为盐类水解都是 反应。 ②浓度:稀释盐溶液,可以 水解,盐的浓度越小,水解程度 。
③外加酸或碱:水解呈酸性的盐溶液,若加入碱,会 水解;加入酸则 水解。水解呈碱性的盐溶液,若加入碱,会 水解;加入酸,会 水解。 ④外加盐:加入与盐的水解性质相反的盐会使盐的水解程度 。
例2 已知CH3COOH、HF均为弱酸,酸性强弱顺序为CH3COOH
知识点二 盐类水解的应用1.在工农业生产和日常生活中的应用(1)用热纯碱溶液清洗油污效果更好,加热促进了盐的水解, 增大。 (2)铵态氮肥不能与草木灰混合施用,铵根离子与碳酸根离子相互促进水解,使生成的氨逸出而降低了 的肥效。 (3)明矾用作净水剂,明矾在水溶液中发生水解产生Al(OH)3胶体,能吸附水中悬浮的杂质,起到净水的作用,有关的离子方程式是 。
(4)泡沫灭火器中分别盛装Al2(SO4)3溶液与小苏打溶液,使用时二者混合发生水解相互促进反应,产生CO2气体和Al(OH)3沉淀,将燃烧物质与空气隔离开来,其水解的离子方程式为 。 (5)工业制备某些无水盐时,不能用蒸发结晶的方法,如海水提镁工艺中,由MgCl2·6H2O制无水MgCl2,需要 加热,否则可能发生反应MgCl2·6H2O Mg(OH)2+2HCl↑+4H2O。
2.在化学实验中的应用(1)盐溶液的配制,如配制FeCl3、SnCl2溶液时应加入少量盐酸,目的是 。 (2)制备胶体,将 FeCl3溶液滴入 中,并加热至沸腾以增大Fe3+的水解程度,从而制备Fe(OH)3胶体。 (3)判断盐溶液蒸干产物,FeCl3溶液蒸干得到 ,进而灼烧得到 。
抑制Fe3+、Sn2+的水解
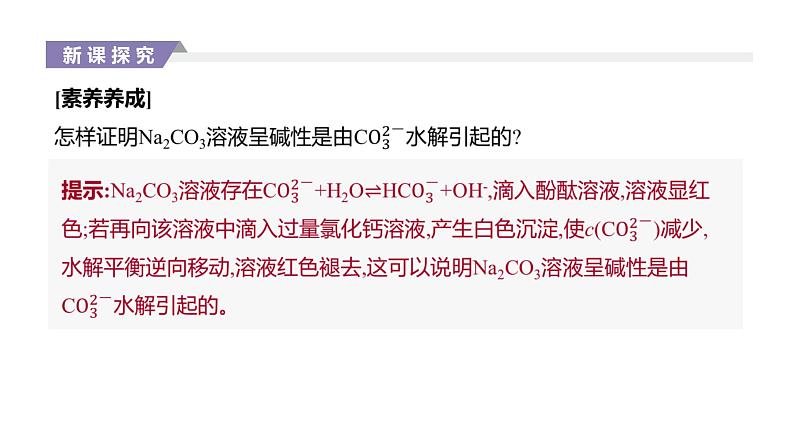
(6)判断盐所对应酸的相对强弱,如相同浓度的NaA和NaB两种盐溶液,其pH前者大于后者,则酸性 。 (7)物质提纯,如除去氯化镁酸性溶液中的氯化铁,可加入 反应掉部分H+,促进铁离子的水解,使Fe3+转化为氢氧化铁沉淀而除去。 (8)比较盐溶液中离子浓度的大小,如Na2CO3溶液中离子浓度的大小顺序为 。
[素养养成] 实验室配制FeCl3溶液时,通常将FeCl3固体先溶解在盐酸中,再加水稀释至所需浓度,为什么?
提示:溶解在盐酸中的目的是抑制Fe3+的水解。
[解析] 铁离子水解呈酸性,加入盐酸可抑制水解,防止溶液变浑浊,但不能加入硫酸,因引入新的杂质,A错误;
例4 为了除去CuCl2酸性溶液中的Fe3+,可在加热搅拌的条件下加入一种试剂,过滤后,再加入适量的盐酸,这种试剂是( )A.NH3·H2O B.NaOH C.Na2CO3 D.CuO
[规律小结] 盐类水解反应除杂规律(1)加入的试剂能与水解产生的H+反应,不引入新杂质,加入过量试剂时也易除去,如除去CuCl2溶液中的FeCl3时,可加入CuO或CuCO3或Cu(OH)2或Cu2(OH)2CO3;除去MgCl2溶液中的Fe3+时,向溶液中加入MgO或Mg(OH)2或MgCO3。(2)除去AlCl3溶液中FeCl2溶液时,应先加H2O2溶液将FeCl2转化为FeCl3,再加Al2O3或Al(OH)3。
知识点三 盐的水解常数1.定义在一定温度下,能水解的盐在水溶液中达到水解平衡时,生成的弱酸(或弱碱)浓度和氢氧根离子(或氢离子)浓度之积与溶液中未水解的弱酸根阴离子(或弱碱的阳离子)浓度之比是一个常数,该常数就叫水解平衡常数。
2.影响因素水解平衡常数是描述能水解的盐水解平衡的主要参数。它只受 的影响,因水解过程是吸热过程,故它随温度的升高而 。
例5 磷酸是三元弱酸,常温下三级电离常数分别是:Ka1=7.1×10-3,Ka2=6.2×10-8,Ka3=4.5×10-13,回答下列问题:(1)常温下同浓度:①Na3PO4、②Na2HPO4、③NaH2PO4的pH由小到大的顺序为 (填序号)。
(2)常温下,NaH2PO4的水溶液pH (填“>”“<”或“=”)7。
(3)常温下,Na2HPO4的水溶液呈 (填“酸”“碱”或“中”)性,用Ka与Kh的相对大小,说明判断理由: 。
[规律小结] KW、Ka(Kb)与Kh的关系
(5)常温下,由水电离出的c(OH-)=10-4 ml·L-1的溶液,既可能是NH4Cl溶液也可能是Na2CO3溶液( )(6)0.1 ml·L-1的Na2SO3溶液与1.0 ml·L-1的Na2SO3溶液相比,其水解程度大,碱性强 ( )
2.配制下列溶液时常需加入少量括号内的物质,其中不是为了抑制离子水解的是( )A.FeSO4(Fe) B.SnCl2(HCl)C.FeCl3(HCl) D.NaAlO2(NaOH)
[解析] A项是为了防止Fe2+被空气中的O2氧化。
3.能促进水的电离,并使溶液中c(H+)>c(OH-)的操作是( )①将水加热煮沸 ②向水中投入一小块金属钠 ③向水中通CO2 ④向水中加入明矾晶体 ⑤向水中加NaHCO3固体 ⑥向水中加NaHSO4固体A.①②④⑤ B.①④⑤ C.③④⑤ D.④
5.现有常温下0.1 ml·L-1 NH4Cl溶液。(1)你认为该溶液呈 性,原因是(用离子方程式表示): 。
5.现有常温下0.1 ml·L-1 NH4Cl溶液。(2)该溶液中离子浓度大小顺序为 。
5.现有常温下0.1 ml·L-1 NH4Cl溶液。(3)用pH试纸测定NH4Cl溶液的pH,其正确的操作是 。
将干燥的pH试纸放在表面皿或者白瓷板上,用玻璃棒蘸待测液体,滴在pH试纸上,当试纸颜色变化稳定后与标准比色卡对比,得出pH
[解析将干燥的pH试纸放在表面皿或者白瓷板上,用玻璃棒蘸待测液体,滴在pH试纸上,当试纸颜色变化稳定后与标准比色卡对比,得出pH。
1.下列有关问题,与盐的水解有关的是( )①NH4Cl与ZnCl2溶液可作焊接金属中的除锈剂②用NaHCO3与Al2(SO4)3两种溶液可作泡沫灭火剂③草木灰与铵态氮肥不能混合施用④实验室盛放碳酸钠溶液的试剂瓶不能用磨口玻璃塞⑤加热蒸干AlCl3溶液得到Al(OH)3固体A.①②③B.②③④C.①④⑤D.①②③④⑤
2.(1)碳酸钾溶液蒸干得到的固体物质是 ,原因是 。 (2)碳酸氢钡溶液蒸干得到的固体物质是 ,原因是 。 (3)亚硫酸钠溶液蒸干得到的固体物质是 ,原因是 。
尽管加热过程促进水解,但生成的KHCO3和KOH反应后又生成K2CO3
Ba(HCO3)2 BaCO3↓+CO2↑+H2O
2Na2SO3+O2=2Na2SO4
高中化学鲁科版 (2019)选择性必修1第2节 弱电解质的电离 盐类的水解课文配套课件ppt: 这是一份高中化学鲁科版 (2019)选择性必修1第2节 弱电解质的电离 盐类的水解课文配套课件ppt
人教版 (2019)选择性必修1第三节 盐类的水解教案配套课件ppt: 这是一份人教版 (2019)选择性必修1第三节 盐类的水解教案配套课件ppt,共60页。PPT课件主要包含了玻璃棒,2实验结果,强碱弱酸,强酸弱碱,氢氧根,盐类水解的特点,盐类水解的规律,课堂回眸等内容,欢迎下载使用。
人教版 (2019)选择性必修1第三节 盐类的水解教课课件ppt: 这是一份人教版 (2019)选择性必修1第三节 盐类的水解教课课件ppt,共35页。PPT课件主要包含了强酸强碱盐,强碱弱酸盐,强酸弱碱盐,2实验结论,OH-,NH3·H2O,H+或OH-,弱电解质,溶于水,水的电离等内容,欢迎下载使用。













