



化学实验活动6 酸、碱的化学性质习题课件ppt
展开红;溶液由红色变成无色;NaOH+HCl===NaCl+H2O;析出白色固体;NaCl
产生蓝色沉淀;CuSO4+2NaOH===Cu(OH)2↓+Na2SO4;沉淀溶解消失,得到蓝色溶液;Cu(OH)2+2HCl===CuCl2+2H2O
铁锈逐渐消失,无色溶液变成黄色;Fe2O3+6HCl===2FeCl3+3H2O;铁钉表面有气泡产生;Fe+2HCl===FeCl2+H2↑
(1)微溶于水;能使无色酚酞试液变红(或能与盐酸反应)(2)CaCl2;HCl
(1)Ca(OH)2+2HCl===CaCl2+2H2O(2)能与某些盐反应(3)A
(1)溶液变蓝 (2)铁锈消失,溶液变为黄色后铁钉表面产生气泡,溶液变为浅绿色;Fe2O3+3H2SO4===Fe2(SO4)3+3H2O、Fe+H2SO4===FeSO4+H2↑
(1)红 (2)2NaOH+CO2===Na2CO3+H2O;密封 (3)酸(4)2NaOH+CuSO4===Cu(OH)2↓+Na2SO4 (5)OH-
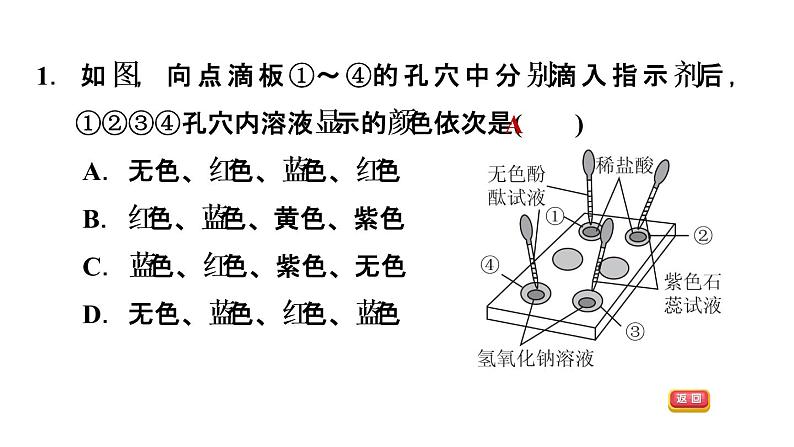
1.如图,向点滴板①~④的孔穴中分别滴入指示剂后,①②③④孔穴内溶液显示的颜色依次是( ) A.无色、红色、蓝色、红色 B.红色、蓝色、黄色、紫色 C.蓝色、红色、紫色、无色 D.无色、蓝色、红色、蓝色
2.取两枚生锈的铁钉分别放入两支试管中,然后分别加入约2 mL稀盐酸,可以观察到的现象是________________________________,写出发生反应的化学方程式______________________________;当铁钉变得光亮时,将其中的一支试管中的铁钉取出,洗净,继续观察另一支试管中的现象,发现溶液由黄色变为浅绿色,_______________________,写出该反应的化学方程式_____________________________。反应一段时间后取出铁钉,发现两枚铁钉的粗细有了明显的变化。
铁锈逐渐消失,无色溶液变成黄色
Fe2O3+6HCl===2FeCl3+3H2O
Fe+2HCl===FeCl2+H2↑
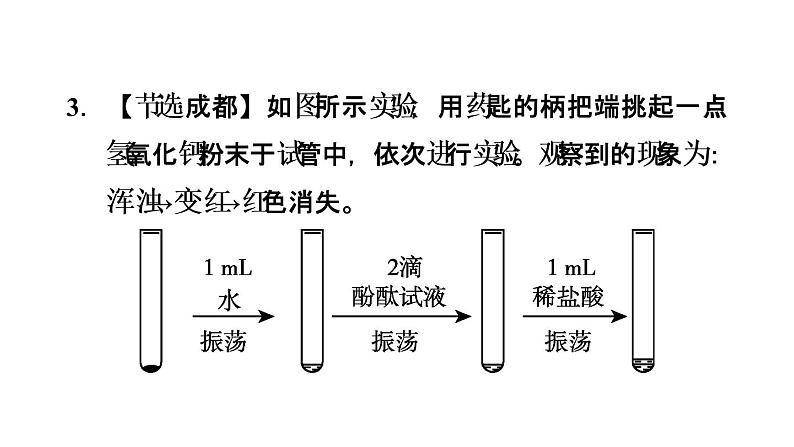
3.【节选·成都】如图所示实验,用药匙的柄把端挑起一点氢氧化钙粉末于试管中,依次进行实验。观察到的现象为:浑浊→变红→红色消失。
(1)根据现象判断氢氧化钙的性质有_________________、_______________________________________(物理性质和化学性质各填一条)。(2)按图实验完毕,所得溶液中除酚酞外一定有的溶质是__________,可能有的溶质是_________________。
能使无色酚酞试液变红(或能与盐酸反应)
4.在试管中加入约2 mL硫酸铜溶液,然后滴入氢氧化钠溶液,观察到的现象是_______________,写出发生反应的化学方程式______________________________________;再向试管中滴入稀盐酸,可观察到_____________________________,写出相关反应的化学方程式__________________________________。
CuSO4+2NaOH===Cu(OH)2↓+Na2SO4
沉淀溶解消失,得到蓝色溶液
Cu(OH)2+2HCl===CuCl2+2H2O
5.向试管中加入约1 mL氢氧化钠溶液,滴入酚酞试液,溶液变________;然后边缓慢滴入稀盐酸边振荡,可观察到________________________,写出发生反应的化学方程式__________________________;取反应后的溶液约1 mL于蒸发皿中加热,液体快蒸干时停止加热,可观察到蒸发皿中________________________,该物质是________。
NaOH+HCl===NaCl+H2O
6.【2019·邵阳】下列物质不能与稀硫酸发生反应的是( ) A.CuO B.Ag C.BaCl2 D.NaOH
7.【中考·河池】下列关于稀盐酸化学性质的描述中,不属于酸的共同性质的是( ) A.能与氧化铝反应生成盐和水 B.能使紫色石蕊试液变红色 C.能与AgNO3反应生成白色沉淀 D.能与氢氧化钠反应生成水
8.【2018·青岛】根据你所学的化学知识和生活经验判断,下列说法错误的是( ) A.打开盛浓盐酸的试剂瓶瓶塞,能闻到刺激性气味,是因为分子在不断地运动 B.滴加洗涤剂能将餐具上的油污洗掉,是因为洗涤剂能溶解油污 C.吃松花蛋时可加入少量食醋,是因为食醋能消除蛋中所含碱性物质的涩味 D.稀盐酸能用来除去铁制品表面的铁锈,是因为稀盐酸能与某些金属氧化物反应
【点拨】洗涤剂去油污是因为洗涤剂具有乳化作用。
9.如图所示,是为了验证稀硫酸化学性质所做的三个实验,回答下列问题。(1)A实验最终能观察到的现象是_______________________。(2)B中可观察到的现象有________________________________________________________,写出发生反应的化学方程式____________________________________________________________________。
铁锈消失,溶液变为黄色后铁钉表面产生气泡,溶液变为浅绿色
Fe2O3+3H2SO4===Fe2(SO4)3+3H2O、Fe+H2SO4===FeSO4+H2↑
10.【2018·北京】下列物质能与NaOH反应的是( ) A.Fe B.CO2 C.Fe2O3 D.NaCl
11.下列有关氢氧化钾的说法正确的是( ) A.氢氧化钾固体露置在空气中易变质 B.氢氧化钾溶液能使石蕊溶液变红 C.氢氧化钾溶液与氧化铜反应生成蓝色沉淀 D.2 mL氢氧化钾溶液与1 mL硫酸溶液恰好完全反应
12.【中考·鄂尔多斯】小红同学将氢氧化钠和氢氧化钙的溶液分别加入试管A、B中,进行了如图所示的三组实验。根据实验Ⅰ、Ⅱ、Ⅲ逐步完成下列问题:
(1)小红设计的实验Ⅰ,证明酸和碱能发生中和反应,写出稀盐酸和氢氧化钙溶液发生反应的化学方程式____________________________________________。(2)实验Ⅱ中,针对反应现象,可总结出碱溶液的化学通性之一是__________________。(3)实验Ⅲ中无明显现象的是试管____(填“A”或“B”)。
Ca(OH)2+2HCl===CaCl2+2H2O
13.归纳总结是学习化学的一种方法,请结合小明同学对碱的四点化学性质的归纳图完成下列问题。(箭头上方的物质是指与碱反应的物质)
(1)碱溶液能使无色酚酞试液变________。
(2)氢氧化钠曝露在空气中变质的化学方程式为____________________________,所以氢氧化钠必须________保存。(3)请帮小明补充完整性质3箭头上方的反应物质是________(填“酸”“碱”或“盐”)。(4)若性质4中产生蓝色沉淀,写出该反应的化学方程式_______________________________________________。(5)碱溶液具有相似的化学性质,是因为碱溶液中都含有______。
2NaOH+CO2===Na2CO3+H2O
2NaOH+CuSO4===Cu(OH)2↓+Na2SO4
14.【2018·湘潭】在M+N→盐+水的反应中,M和N不可能是( ) A.HCl和NaOH B.CO2和Ca(OH)2 C.H2SO4和Fe2O3 D.AgNO3和BaCl2
15.【中考·益阳】如图所示,当胶头滴管中的液体滴入锥形瓶中时,会引起气球膨胀的是( )
【点拨】过氧化氢在二氧化锰的催化作用下生成水和氧气,锥形瓶内气体体积增加,瓶内压强增大,气球缩小,故A选项错误;锌与稀硫酸反应生成硫酸锌和氢气,锥形瓶内气体体积增加,瓶内压强增大,气球缩小,故B选项错误;浓硫酸溶于水放出大量的热,锥形瓶内气体受热膨胀,气球缩小,故C选项错误;氯化氢气体能与石灰水反应生成氯化钙和水,锥形瓶内气体体积减小,瓶内压强减小,气球膨胀,故D选项正确。
16.【中考·巴中】下列物质的变化中,只有加酸才能一步实现的是( ) A.CaCO3→CO2 B.Zn→ZnSO4 C.CuO→CuCl2 D.KOH→KCl
【点拨】CaCO3既可以与酸反应生成CO2,也可以高温分解生成CO2;Zn既可以与稀H2SO4反应生成ZnSO4,也可以与CuSO4反应生成ZnSO4;CuO只有与稀盐酸反应才能生成CuCl2;KOH既可以与稀盐酸反应生成KCl,也可以与CuCl2等反应生成KCl。
17.【改编·西宁】氢氧化钴[C(OH)2]受热易分解,能与酸性溶液反应,可作涂料的干燥剂,制备方法是①C+2HCl===CCl2+H2↑,②CCl2+2NaOH===C(OH)2↓+2NaCl。下列说法中正确的是( ) A.氢氧化钴的化学性质稳定 B.氢氧化钴可以干燥氯化氢气体 C.可以用适量NaOH溶液除去NaCl中混有的少量CCl2 D.C(OH)2中C元素的化合价为+4
【点拨】氢氧化钴受热易分解,化学性质不稳定,故A错误;氢氧化钴是一种碱,能与酸发生反应,因此不能用来干燥氯化氢气体,故B错误;C正确;C(OH)2中OH-显-1价,则C元素显+2价,故D错误。
18.【2018·本溪】A、B、C、D、E是初中化学常见的物质。其中A是通常状况下密度最小的气体,B和C反应可形成蓝色溶液,D在农业上可用来改良酸性土壤。它们的相互关系如图所示(图中“—”表示两端的物质能发生化学反应,“→”表示物质间的转化关系,部分反应物、生成物及反应条件已略去)。
请回答:(1)B的化学式是________。(2)C的类别是________(填“氧化物”“酸”或“盐”)。(3)反应E→A的化学方程式为__________________________,反应D→E的化学方程式为_________________________________________________________________________________。
Ca(OH)2+CO2===CaCO3↓+H2O[或Ca(OH)2+2HCl===CaCl2+2H2O]
化学九年级下册实验活动6 酸、碱的化学性质优秀课件ppt: 这是一份化学九年级下册实验活动6 酸、碱的化学性质优秀课件ppt,共26页。PPT课件主要包含了碱的化学性质,探究酸的性质,实验现象及结论,感悟新知,探究碱的性质,产生红褐色沉淀等内容,欢迎下载使用。
初中化学第十单元 酸和碱实验活动6 酸、碱的化学性质教学课件ppt: 这是一份初中化学第十单元 酸和碱实验活动6 酸、碱的化学性质教学课件ppt,共17页。PPT课件主要包含了新课导入,新课推进,交流回答,课堂小结,板书设计等内容,欢迎下载使用。
人教版第十单元 酸和碱实验活动6 酸、碱的化学性质背景图ppt课件: 这是一份人教版第十单元 酸和碱实验活动6 酸、碱的化学性质背景图ppt课件,共26页。PPT课件主要包含了化学和我们有什么关系,绚丽多彩的化学世界,在工业方面,人工生产的钻石,冶炼钢铁,在农业方面,在医药卫生方面,SARS疫苗,杀菌消毒,在材料方面等内容,欢迎下载使用。













