




化学实验活动6 酸、碱的化学性质背景图ppt课件
展开1.通过本实验活动,加深对酸和碱的主要性质的认识;2.培养学生的实验操作能力和实验安全意识;3.通过实验解释生活中的一些现象。
(1)酸能与指示剂反应;(2)酸能与活泼金属作用;(3)酸能与某些金属氧化物反应。 2.碱的化学性质:(1)碱能与指示剂反应;(2)碱能与某些非金属氧化物反应。
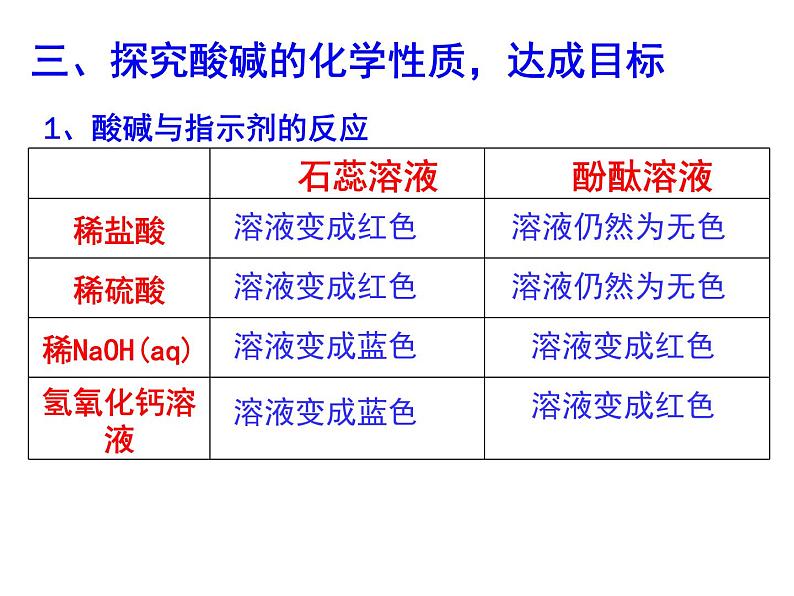
三、探究酸碱的化学性质,达成目标
1、酸碱与指示剂的反应
1.酸溶液能使紫色石蕊溶液变成红色
2.碱溶液 (1)能使紫色石蕊溶液变成蓝色;(2)能使无色酚酞溶液变成红色。
酸和碱能跟酸碱指示剂作用而显示不同的颜色。酸能使紫色石蕊溶液变成红色,不能使无色酚酞溶液变色;碱能使紫色石蕊溶液变成蓝色,使无色酚酞溶液变成红色。酸和碱有腐蚀性,实验时应注意安全。
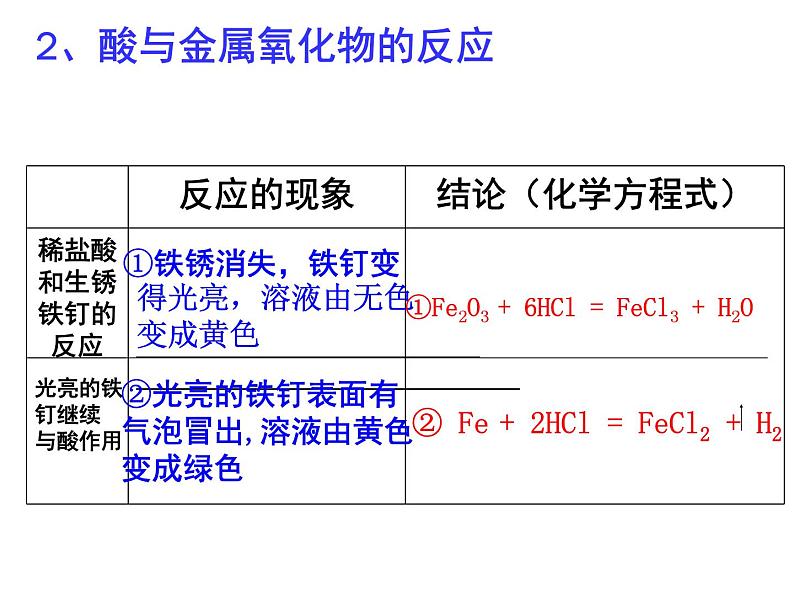
①铁锈消失,铁钉变 得光亮,溶液由无色 变成黄色
②光亮的铁钉表面有气泡冒出,溶液由黄色变成绿色
①Fe2O3 + 6HCl = FeCl3 + H2O
光亮的铁钉继续与酸作用
2、酸与金属氧化物的反应
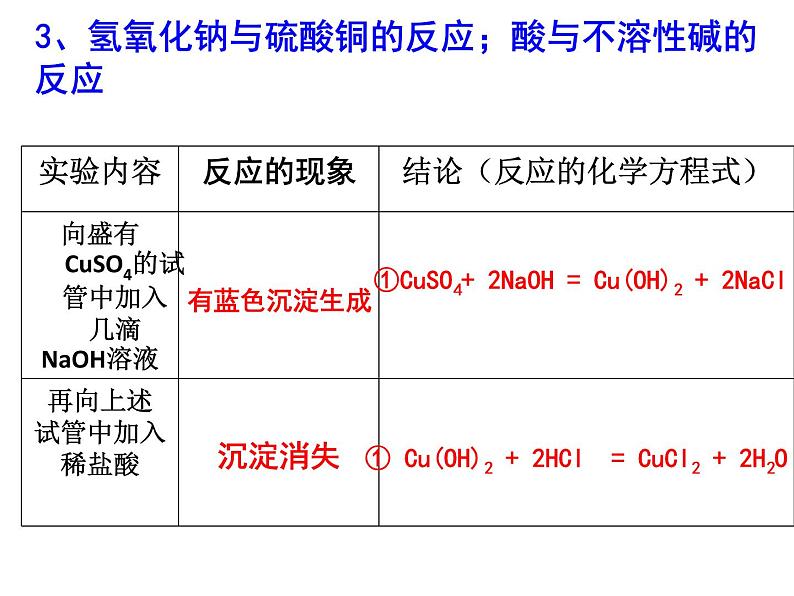
3、氢氧化钠与硫酸铜的反应;酸与不溶性碱的反应
①CuSO4+ 2NaOH = Cu(OH)2 + 2NaCl
① Cu(OH)2 + 2HCl = CuCl2 + 2H2O
NaOH + HCl = NaCl + H2O
5、验证氢氧化钙的性质
有固体未溶解溶液由无色变为红色
有固体未溶解溶液由无色变为红色,加入盐酸后,固体全部溶解,溶液由红色变为无色
氢氧化钙微溶于水,水溶液称碱性
Ca(OH)2+ 2HCl=CaCl2 + 2H2O
1.比较酸和碱与指示剂的作用,你发现了什么现象? 2.取两根生锈的铁钉放入两支试管中,然后加入约2 mL稀盐酸,观察现象。将铁钉放入试管应如何操作? 3.硫酸铜溶液中滴入几滴氢氧化钠溶液,你发现了什么现象?
【教师点拨】1.使用点滴板的作用是:节约药品,同时便于观察和对比实验现象。2.在实验操作之前,小组的同学应该先制定好实验步骤再进行实验,以防手忙脚乱。3.实验步骤5通过实验对比说明氢氧化钙粉末能与盐酸发生反应,同时也说明了氢氧化钙微溶于水,水溶液呈碱性。
四、【典例精讲】如右图所示,田绘同学在进行酸碱中和反应的实验时,向烧杯中的氢氧化钠溶液滴加稀盐酸一会儿后,发现忘记了滴加指示剂。为了确定盐酸与氢氧化钠是否恰好完全反应,田绘从烧杯中取少量反应后的溶液放于一支试管中,并向试管中滴加几滴无色酚酞试液,振荡后观察到酚酞试液不变色。于是她得出“两种物质已恰好完全中和”的结论。
(1)你认为她得出的结论是否正确?____________,理由是:______________。(2)写出该中和反应的化学方程式_________________________。(3)请你另设计一个实验,探究上述烧杯中的溶液是否恰好完全中和,填写下表:
答案:(1)不正确,因为还可能是盐酸过量。(2)NaOH+HCl====NaCl+H2O(3)以下方法任写一种均可:归纳:酸与碱中和反应后一般存在三种情况:酸碱恰好反应;酸过量;碱过量。
思路点拨:解答此题有三个关键:一是要明确中和反应过程中溶液酸碱性的变化情况,滴加的稀盐酸过少,溶液显碱性;恰好完全反应,溶液显中性;滴加的稀盐酸过多,溶液显酸性。二是要明确酚酞不变色,溶液可能显中性,也有可能显酸性。三是要明确第(3)问中的“另设计一个实验”应在已经知道溶液“要么恰好完全中和,要么盐酸过量”的基础上考虑实验方法。
五、总结梳理 内化目标
1.酸碱和指示剂的反应:2.铁锈、铁钉和稀盐酸的反应3.硫酸铜和氢氧化钠反应4.氢氧化钠和稀盐酸的反应以及蒸发溶液5.氢氧化钙和稀盐酸的反应
1.酸碱能使指示剂变色,而不是酸碱变色。2.生锈的铁钉放入盐酸中先后会发生两个反应。3.稀盐酸也能与不溶于水的碱(如氢氧化铜)发生反应。
1.储存和运输浓盐酸、浓硫酸、氢氧化钠的容器上都应张贴的图标是( )
2.稀盐酸是化学实验中常用的试剂,但下列实验中,不宜使用稀盐酸的是( ) A.除去氯化钠溶液中的碳酸钠 B.除去铜粉中混有的铁粉 C.除去熟石灰中的石灰石 D.除去铁丝上的铁锈
3.下列物质不能用于鉴别氢氧化钠溶液和稀盐酸的是( ) A.紫色石蕊溶液 B.氯化钠溶液 C.铁粉 D.pH试纸
答案:(1)K2SO4 (2)(NH4)2SO4 (3)NaOH,HNO3 (4)Ca(OH)2 2HCl
人教版九年级下册实验活动6 酸、碱的化学性质课文内容课件ppt: 这是一份人教版九年级下册实验活动6 酸、碱的化学性质课文内容课件ppt,共26页。PPT课件主要包含了课堂检测,实验内容,图10-S-1,金属氧,气泡冒出,活泼金属,HCl+,H2↑,产生蓝,色沉淀等内容,欢迎下载使用。
人教版九年级下册实验活动6 酸、碱的化学性质教学演示ppt课件: 这是一份人教版九年级下册实验活动6 酸、碱的化学性质教学演示ppt课件,共22页。PPT课件主要包含了见习题,答案显示,答案C,Na+和SO42-,溶液中都含有H+,硫酸钠,答案D,气球膨胀等内容,欢迎下载使用。
人教版九年级下册实验活动6 酸、碱的化学性质课堂教学课件ppt: 这是一份人教版九年级下册实验活动6 酸、碱的化学性质课堂教学课件ppt,共28页。PPT课件主要包含了答案显示,见习题,答案B,答案C,复分解反应,Fe3O4,NaOH,OH-,改良酸性土壤,CaCO3等内容,欢迎下载使用。













