






化学九年级下册课题 2 金属的化学性质背景图ppt课件
展开
这是一份化学九年级下册课题 2 金属的化学性质背景图ppt课件,共20页。PPT课件主要包含了大量气泡反应最快,许多气泡反应较快,无明显现象,不反应,反应类型,置换反应,其活动性位于H之前,必须可溶,金属的活动性,考点3置换反应等内容,欢迎下载使用。
课前热身: 有X、Y、Z、W四种金属,只有W能在自然界中以单质形式存在;如果把Z和Y分别放入稀盐酸中,Z溶解并产生氢气,Y不反应;如果把X和Y分别放入硝酸银溶液中,过一会儿,在Y表面有银析出,而X没有变化。根据以上实验事实,判断这三种金属的活动性由强到弱的顺序为( )A. Z>Y>X >W B. W>Z>Y> X C. Y>X>Z>W D. W>X>Z>Y
① W排在最后;
② Z >H >Y;
③ Y >Ag >X;
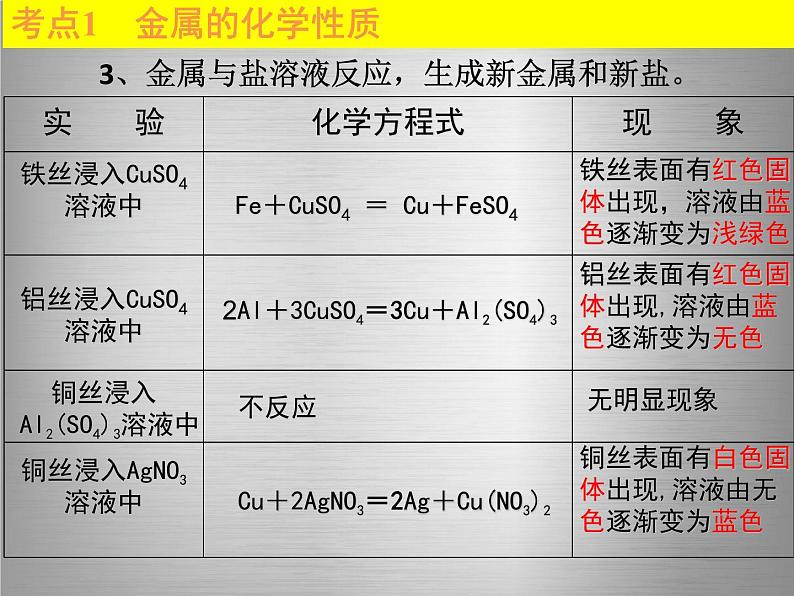
考点1 金属的化学性质
1、金属与氧气反应,生成金属氧化物。
镁、铝、锌等金属在常温下就能与氧气反应;铁、铜等金属在高温下能与氧气反应;金很难与氧气反应。
(发出耀眼的白光,生成白色固体)
(Al2O3结构致密,能起保护作用)
(剧烈燃烧,火星四射,生成黑色固体)
2、金属与盐酸、稀硫酸反应,生成盐和氢气。
Mg+H2SO4=MgSO4+H2↑Mg+2HCl=MgCl2+H2↑
Zn+H2SO4=ZnSO4+H2↑Zn+2HCl=ZnCl2+H2↑
少量气泡,反应较慢,溶液由无色变为浅绿色
Fe+H2SO4=FeSO4+H2↑Fe+2HCl=FeCl2+H2↑
盐酸、稀硫酸(浓硫酸、硝酸除外)
[注意] ①实验前应先用砂纸将金属表面打磨干净,以除去金属表面的“锈”或“氧化膜”。 ②铁发生置换反应时,只能生成亚铁离子,溶液的颜色是浅绿色。 ③相同质量的金属与足量酸完全反应,生成H2的质量由多到少依次是:铝>镁>铁>锌
3、金属与盐溶液反应,生成新金属和新盐。
铁丝表面有红色固体出现,溶液由蓝色逐渐变为浅绿色
Fe+CuSO4 = Cu+FeSO4
铝丝表面有红色固体出现,溶液由蓝色逐渐变为无色
2Al+3CuSO4=3Cu+Al2(SO4)3
铜丝表面有白色固体出现,溶液由无色逐渐变为蓝色
Cu+2AgNO3=2Ag+Cu(NO3)2
位于盐中金属之前(K、Ca、Na除外)
[注意] ①实验前应先用砂纸将金属表面打磨干净,以除去金属表面的“锈”或“氧化膜”。 ②铁发生置换反应时,只能生成亚铁离子,溶液的颜色是浅绿色。
考点2 金属的活动性顺序
钾 钙 钠 镁 铝 锌 铁 锡 铅(氢)铜 汞 银 铂 金K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
一、金属的位置越靠前,它的活动性就越强;
二、位于氢前的金属能置换出盐酸、稀硫酸中的氢;
三、位于前面的金属能把位于后面的金属从它们的化合物的溶液中置换出来。
一种单质与一种化合物作用生成另一种单质和另一种化合物的反应。
A + BC → AC + B
Mg+H2SO4=MgSO4+H2↑
Fe+CuSO4 =Cu+FeSO4
单质金属位于盐中金属之前
1、(2014衡阳20题2分)相同质量的M、N两种金属,分别与相同质量分数的足量稀盐酸反应(M、N在生成物中均为+2价),生成H2质量和反应时间的关系如图所示。下列有关叙述正确的是( )A. 金属活动性:N>MB. 生成H2的质量相等C. 相对原子质量:N>MD. 消耗盐酸的质量相等
2、 (2014永州17题2分)锌与金属M的硫酸盐溶液发生反应的化学方程式为Zn+MSO4=== ZnSO4+M,下列说法正确的是( )A. 金属M的活动性比Zn强B. 金属M一定是CuC. 该反应属于置换反应D. 反应后溶液的质量一定减少
3、(2015郴州11题2分)下列可用于验证Fe、Cu、Ag三种金属的活动性顺序的一组药品是( )A. Fe、Cu、H2SO4溶液B. Cu、Ag、FeSO4溶液C. Fe、Ag、CuSO4溶液D. Ag、FeSO4溶液、CuSO4溶液
4、(2013娄底26题9分)小聪同学家新换了水龙头,从说明书上了解到该水龙头是铜质镀铬。好奇的小聪想探究铬(Cr)与常见金属铁、铜的活动性强弱,邀请你一同参加。【知识回放】金属活动性顺序:K Ca Na Mg Al Zn______Sn Pb(H)______ Hg Ag Pt Au,请你在横线上填写对应金属的元素符号。【作出猜想】 猜想1.Cr>Fe>Cu; 猜想2.Fe>Cu>Cr; 猜想3.你的猜想是___________。【查阅资料】(1)铬是银白色有光泽的金属,在空气中其表面能生成抗腐蚀的致密的氧化膜。(2)铬能与稀硫酸反应,生成蓝色的硫酸亚铬(CrSO4)溶液。【设计与实验】小聪同学取大小相等的三种金属片,用砂纸打磨光亮;再取三支试管,分别放入等量的同种稀硫酸。
【结论与解释】 (1)小聪得到的结论是猜想________正确。 (2)实验前用砂纸打磨金属片的目的是_______________________________________________________。【知识运用】 将铬片投入FeSO4溶液中,反应________(填“能”或“不能”)进行。若能进行,请你写出反应的化学方程式___________________________________________________。
除去金属表面的氧化膜或污物,防止其阻止反应
Cr+FeSO4 = Fe+CrSO4
5、(2014湘潭20题2分)某溶液中含有Cu(NO3)2和AgNO3,现向其中逐渐加入一定质量的铁粉进行处理,并绘制参加反应的铁的质量与溶液中溶质种类的关系图。下列说法正确的是( )A. a点溶液中溶质为3种时,金属单质的种类也为3种B. 当溶质种类为2种时,金属单质种类可能为2种C. a、b两点,溶液的质量相等 D. 当溶质种类为1种时,金属单质种类可能为1种
=Fe(NO3)2 + 2Ag
=Fe(NO3)2 + Cu
2AgNO3 + Cu = Cu(NO3)2 + 2Ag
Fe(NO3)2AgNO3Cu(NO3)2
Fe(NO3)2Cu(NO3)2
下列说法正确的是( )A. a点溶液中溶质为3种时,金属单质的种类也为3种B. 当溶质种类为2种时,金属单质种类可能为2种C. a、b两点,溶液的质量相等 D. 当溶质种类为1种时,金属单质种类可能为1种
相关课件
这是一份化学课题 2 金属的化学性质教课ppt课件,共26页。PPT课件主要包含了学习目标,已知信息,成果展示,联系生活,科学家的故事,锌铁铜,金属和盐酸的反应,活动与探究,金属的活动性顺序,金属活动性等内容,欢迎下载使用。
这是一份化学课题 2 金属的化学性质图文课件ppt,共32页。PPT课件主要包含了学习目标,金属与氧气的反应,金不能和氧气反应,综合上述信息可知,不相同,活动与探究,活动探究,知识归纳,化合物,置换反应等内容,欢迎下载使用。
这是一份初中化学人教版九年级下册第八单元 金属和金属材料课题 2 金属的化学性质授课ppt课件,共20页。PPT课件主要包含了学习目标,温故而知新,纯金属,电和热,延展性,回顾已知,想一想,归纳小结,产生大量气泡,产生少量气泡等内容,欢迎下载使用。










