





人教版第十单元 酸和碱课题1 常见的酸和碱课堂教学ppt课件
展开
这是一份人教版第十单元 酸和碱课题1 常见的酸和碱课堂教学ppt课件,共18页。PPT课件主要包含了活动与探究一,活动与探究二,活动与探究三,酸的化学性质等内容,欢迎下载使用。
知识与能力目标 :1、通过实验探究,认识酸的化学性质,并能准确的描述实验现象。2、通过动手动脑,培养学生的观察能力,分析能力,解决问题的能力。3、使学生逐步懂得从个别到一般的认识事物规律的过程。
过程与方法目标:1、通过对酸的化学性质的研究,熟练书写化学方程式。2、初步学会运用观察、实验等方法获取信息。
情感、态度与价值观:1、培养实事求是的科学探究态度。2.保持和增强对生活和自然界中化学现象的好奇心和探究欲,提高学习化学的兴趣。3、培养善于合作、勤于思考、严谨求实、勇于探究的科学精神。
实验室有两瓶无标签的液体分别是稀硫酸和蒸馏水,请同学们利用提供的试剂,将这两种液体一次性鉴别出来?
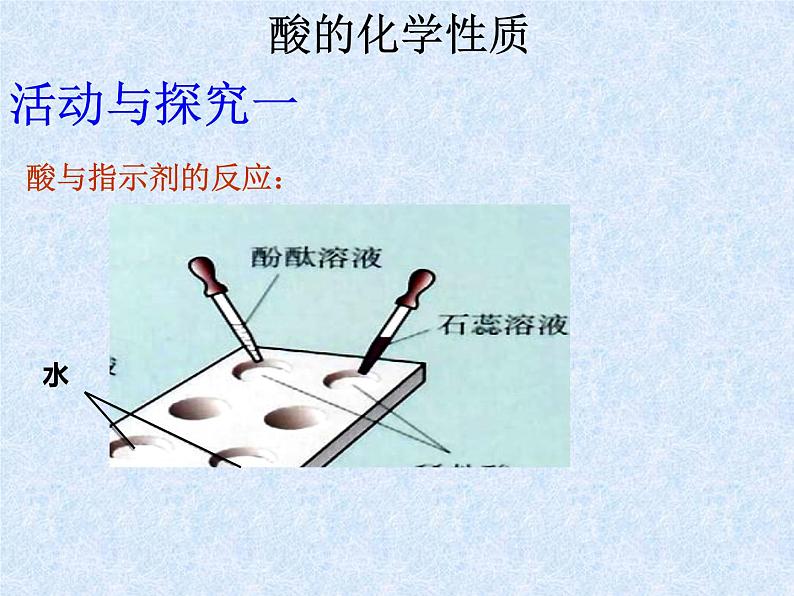
试剂:紫色石蕊试液 无色酚酞试液
(1)酸与指示剂反应:
酸能使紫色石蕊试液变成红色,使无色酚酞试液不变色。
向某溶液中滴入无色酚酞不显色,向该溶液中滴入紫色石蕊试液则
A、一定显红色B、可能仍为紫色,也可能显红色C、可能显蓝色D、一定显无色
这两瓶未贴标签的稀硫酸和蒸馏水,请同学们想想还可以用什么方法鉴别?
方案一:用紫色石蕊溶液
方案二:用 来鉴别
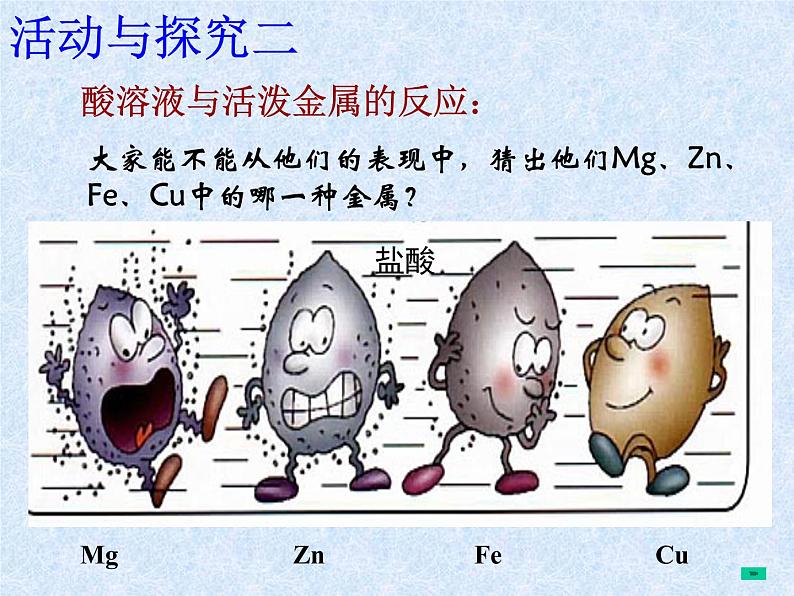
酸溶液与活泼金属的反应:
大家能不能从他们的表现中,猜出他们Mg、Zn、Fe、Cu中的哪一种金属?
(2)酸溶液与活泼金属反应:(请回忆并填表)
Mg+2HCl=MgCl2 +H2 ↑Zn+2HCl=ZnCl2 +H2 ↑Fe+2HCl=FeCl2 +H2↑
Mg+H2SO4=MgSO4+H2 ↑Zn+H2SO4=ZnSO4+H2 ↑Fe+H2SO4=FeSO4+H2↑
讨论:上面反应的生成物有什么共同之处?
上述反应都会生成氢气,另一生成物是金属离子与酸根离子构成的化合物(盐)
酸 + 活泼金属 → 盐 + 氢气
(1)酸:指HCl、稀硫酸
(2)活泼金属 :指金属活动顺序表中,H前的金属K、Ca、Na三种金属非常活泼,它们不是与酸 反应,而是与水反应
(3)铁+酸:生成浅绿色的亚铁盐(+2价)
生活中,你对生锈的铁钉如何除锈?
向盛有一枚生锈的铁钉的试管中加入稀盐酸,振荡,过会儿观察现象?
探究:酸溶液与金属氧化物的反应:
(3)酸溶液与金属氧化物反应:
①铁锈逐渐消失,②溶液由无色溶液变黄色。
Fe2O3 + 6HCl = 2FeCl3+ 3H2O
Fe2O3+3H2SO4=Fe2(SO4)3+3H2O
讨论:①上面反应的生成物有什么共同之处?
上述反应的生成物之一都是水,另一生成物是金属离子与酸根离子构成的化合物(盐)
酸 + 金属氧化物→盐 + 水
1.生锈的铁器在用稀盐酸或稀硫酸除锈时,能否长时间浸泡?为什么?
Fe+2HCl=FeCl2+H2↑
Fe2O3+3H2SO4=Fe2(SO4)3+3H2O
Fe2O3+6HCl=2FeCl3+3H2O
Fe+H2SO4=FeSO4+H2↑
你能运用“酸的化学性质”解决实际问题吗?
当酸过量时,与铁锈反应剩余的酸就会继续与铁反应,长时间浸泡会使铁制品受到腐蚀。
将一只生锈的铁钉浸入足量的稀盐酸中,可看到 现象,化学方程式为 ,过一会儿可 ,化学方程式为 ,
Fe2O3+6HCl=2FeCl3+3H2O
Fe+2HCl=FeCl2+H2↑
铁锈逐渐消失 , 溶液由无色变黄色
铁钉表面有气泡,溶液变浅绿色
(4)酸跟盐发生的反应
已知鸡蛋壳的主要成分是碳酸钙,知识回忆 ↙
CaCO3+2HCl=CaCl2+H2O+CO2↑
酸的化学性质1、跟指示剂的反应2、跟金属的反应3、跟金属氧化物的反应4、跟某些盐的反应
工业上想要除去铜粉中混有的少量氧化铜粉末,可以用怎样的办法?
可以加入盐酸,盐酸不会和铜粉反应,但是可以和氧化铜反应。
CuO + 2HCl === CuCl2 + H2O
相关课件
这是一份化学九年级下册课题1 常见的酸和碱多媒体教学课件ppt,共12页。PPT课件主要包含了新课导入,酸的化学性质,不变色无色,典型例题等内容,欢迎下载使用。
这是一份人教版九年级下册第十单元 酸和碱课题1 常见的酸和碱集体备课课件ppt,共12页。PPT课件主要包含了变红色,不变色,变蓝色,自制酸碱指示剂,典型例题等内容,欢迎下载使用。
这是一份初中化学人教版九年级下册课题1 常见的酸和碱背景图课件ppt,文件包含第2课时酸的化学性质pptx、2酸与指示剂反应mp4、酸与活泼金属的反应mp4、铁锈与稀硫酸反应mp4等4份课件配套教学资源,其中PPT共38页, 欢迎下载使用。









