




人教版九年级下册课题3 溶液的浓度授课ppt课件
展开在一定温度下、一定量的溶剂中,溶质不能继续溶解的溶液。
2、饱和溶液和不饱和溶液之间的相互转化方法
在一定温度下,某固态物质在100克溶剂里达 到饱和状态时所溶解的质量, 叫做这种物质在这种溶剂里的溶解度。
指该气体的压强为101KPa和一定温度时,在1体积水里溶解达到饱和状态时的气体体积。
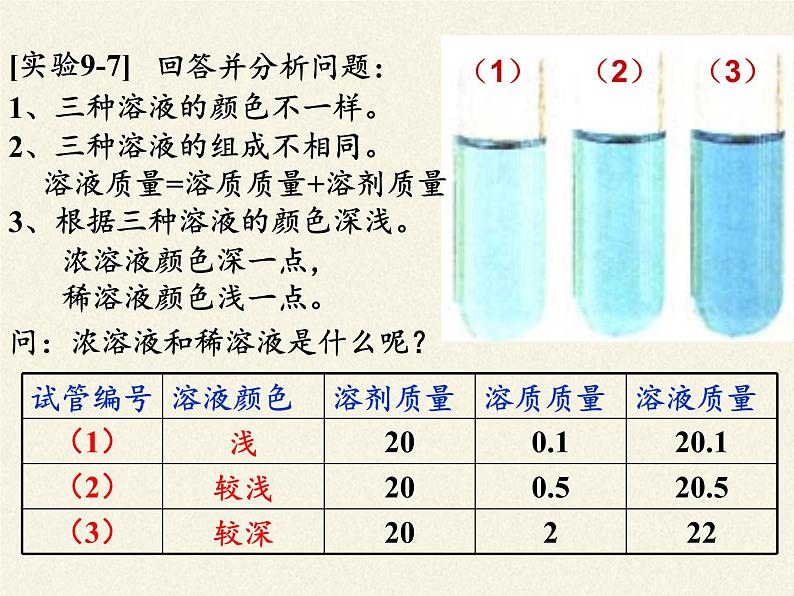
1、三种溶液的颜色不一样。
2、三种溶液的组成不相同。
3、根据三种溶液的颜色深浅。
浓溶液颜色深一点,稀溶液颜色浅一点。
问:浓溶液和稀溶液是什么呢?
溶液质量=溶质质量+溶剂质量
药液太稀不能杀死害虫和病菌,但药液太浓又会毒害农作物或树木。
1.对于有色溶液,我们可以根据颜色深浅来判断溶液是浓还是稀;但是这种分法比较粗略,不能准确地表明一定量溶液里究竟含有多少溶质。
在实际应用中,常常要准确知道一定量溶液里含有多少溶质,即溶液的浓度(浓稀程度)。
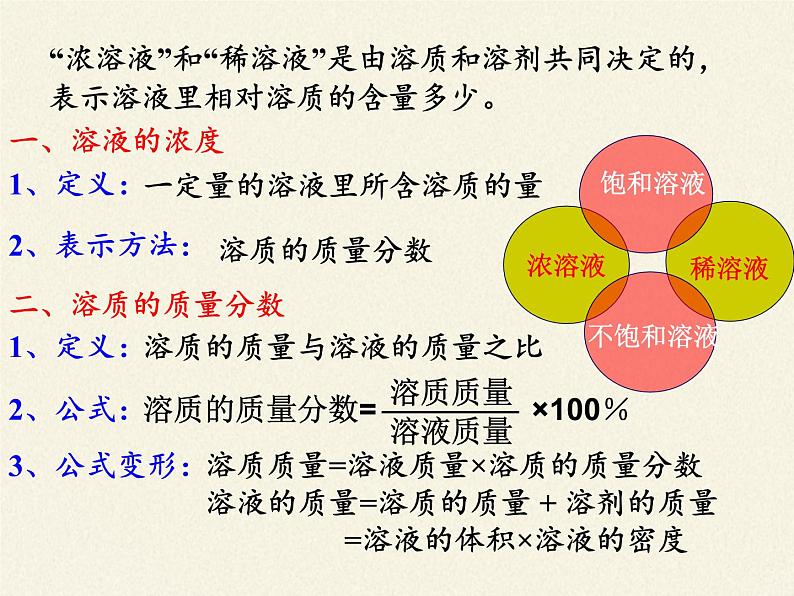
“浓溶液”和“稀溶液”是由溶质和溶剂共同决定的,表示溶液里相对溶质的含量多少。
一定量的溶液里所含溶质的量
溶质的质量与溶液的质量之比
溶质质量=溶液质量×溶质的质量分数
溶液的质量=溶质的质量 + 溶剂的质量 =溶液的体积×溶液的密度
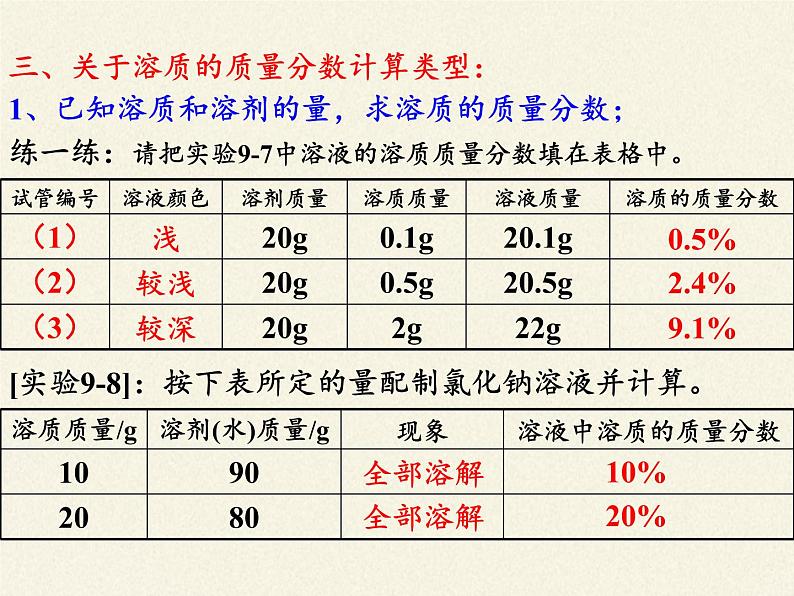
练一练:请把实验9-7中溶液的溶质质量分数填在表格中。
1、已知溶质和溶剂的量,求溶质的质量分数;
三、关于溶质的质量分数计算类型:
[实验9-8]:按下表所定的量配制氯化钠溶液并计算。
讨论:已知20℃时,氯化钠的溶解度是36g。有人说: “20℃时氯化钠饱和溶液中溶质的质量分数为 36%。”这种说法对吗?为什么?
不对。 20℃时,氯化钠的溶解度是36g。 意思是:溶质质量36g,溶剂质量100g; 溶液质量不是100g,而是100g+36g=136g。 溶质的质量分数应为:36÷136×100%=26.5%
练习:(课本P45)1、在20℃时,将40g硝酸钾固体加入 100g水中,充分搅拌后,仍有8.4g硝酸钾固体 未溶解。请填写下列空白: ① 所得溶液是20℃时硝酸钾的 溶液; (填“饱和”或“不饱”) ② 20℃时硝酸钾的溶解度为 ; ③ 所得溶液中硝酸钾的质量分数为 。
2、要配制一定量的溶质的质量分数一定的溶液, 计算所需溶质和溶剂的量;
【例题1】在农业生产中,常需要用质量分数为16%的氯 化钠溶液来选种。现要配制150kg这种溶液, 需要氯化钠和水的质量各是多少?
答: 配制150kg质量分数为16%的氯化钠溶液 需24 kg氯化钠和126 kg水。
【解】溶液质量 = 溶液体积 × 溶液密度
= 500mL ×1.1g/cm3 = 550g
溶质质量 = 550g ×10% = 55g
溶剂质量 = 550g — 55g = 495g
答:需要氢氧化钠55g,水495g。
练习:(课本P45)4、配制500mL质量分数为10%的氢氧化钠溶液 (密度为1.1g/cm3),需要氢氧化钠和水的质量各是多少?
练习:(课本P45)2、某温度时,蒸干35g氯化钾溶液, 得到7g氯化钾,求该溶液中溶质的质量分数。
答:该溶液中溶质的质量分数为20%
【分析】 溶液稀释前后,溶质的质量不变
【解】 设:稀释后溶液的质量为X。
50g × 98% = X × 20%
需要水的质量 = 245g - 50g = 195g
答:需要水的质量为195g。
【例题2】化学实验室现有质量分数为98%的浓硫酸, 但在实验中常需要用较稀的硫酸。要把50g 上述浓硫酸稀释为质量分数为20%的硫酸, 需要水的质量是多少?
【解】设:稀释后溶液的质量为X。
100g × 98% = X × 10%
需要水的质量 = 980g - 100g = 880g
答:需要水的质量为880g。
练习:(课本P45)3、把100g质量分数为98%的浓硫酸 稀释成10%的稀硫酸,需要水的质量是多少?
溶液中溶质的质量分数是溶质质量与溶液质量之比:
可利用上式进行质量分数的有关计算,并根据需要配制一定质量分数的溶液。
4、把溶质的质量分数运用于化学方程式的计算
【课本P45】5、 100g某硫酸溶液恰好与13g锌完全反应, 试计算这种硫酸中溶质的质量分数。
【解】 :设这种硫酸中溶质的质量为X
Zn + H2SO4 = ZnSO4 + H2↑
65 98
13g X
答:这种硫酸溶液中溶质的质量分数为19.6%。
【解】 :盐酸中溶质的质量为:73g×20% = 14.6g
练习:(课本P45)6、73g质量分数为20%的盐酸与足量 大理石反应,生成二氧化碳的质量是多少? 这些二氧化碳的体积(标准状况)是多少? (在标准状况下,CO2的密度为1.977g/L。)
CaCO3 + 2HCl = CaCl2 + CO2↑ + H2O
设生成二氧化碳的质量为X
73 44
14.6g X
二氧化碳的体积 = 8.8g÷1.977g/L = 4.45L
答:CO2的质量为8.8g;CO2的体积为4.45L
化学九年级下册课题3 溶液的浓度评优课ppt课件: 这是一份化学九年级下册<a href="/hx/tb_c76882_t3/?tag_id=26" target="_blank">课题3 溶液的浓度评优课ppt课件</a>,共28页。PPT课件主要包含了溶液的浓度,20ml水,44%,09%,完全溶解,≈265%等内容,欢迎下载使用。
化学课题3 溶液的浓度教学课件ppt: 这是一份化学课题3 溶液的浓度教学课件ppt,共8页。PPT课件主要包含了Vc泡腾片,实验演示,溶质的质量分数,拓展应用,推导提高等内容,欢迎下载使用。
初中化学人教版九年级下册课题3 溶液的浓度教案配套课件ppt: 这是一份初中化学人教版九年级下册课题3 溶液的浓度教案配套课件ppt,共8页。PPT课件主要包含了你知道吗,溶质质量分数,溶质质量,溶液质量,相关计算《一》,练一练1,中考易错点,让我们动起手来,相关计算《二》,让我们开动脑筋等内容,欢迎下载使用。













