






初中人教版第三单元 物质构成的奥秘综合与测试复习课件ppt
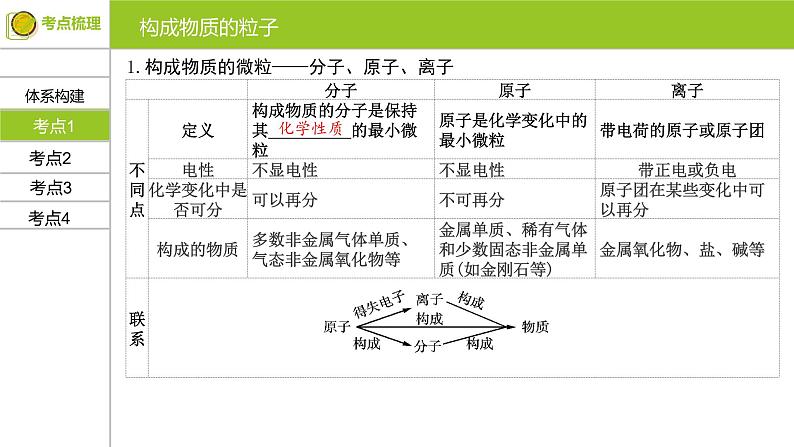
展开1.构成物质的微粒——分子、原子、离子
易失分点分子和原子概念的理解误区1、分子只能保持物质的化学性质,不能保持物质的物理性质。2、在化学变化中,分子可以再分,原子不可以再分。若离开了化学变化这一范围,分子、原子都是可以再分的,分子可以分成原子,原子又可以分成质子、中子和电子。
1.(2020•淄博)化学是在原子、分子水平上研究物质及其变化规律的一门学科,它能指导我们更好地认识、改造和应用物质。以下说法正确的是( )A.质子、中子、电子都可以直接构成物质B.原子、分子、离子都可以直接构成物质C.分子是由原子构成的,水由氢原子和氧原子构成D.分子是构成物质的基本粒子,空气由空气分子构成
【答案】B【解答】解:A、原子、分子、离子都可以直接构成物质,故选项说法错误;B、原子、分子、离子都可以直接构成物质,故选项说法正确;C、分子是由原子构成的,水分子由氢原子和氧原子构成,故选项说法错误;D、分子是构成物质的基本粒子,空气是混合物,不是由空气分子构成,故选项说法错误;故选:B。
2.(2020•赤峰)下列物质中含氧分子的是( )A.空气B.氯酸钾C.过氧化氢D.高锰酸钾
【答案】A【解答】解:A、空气中含有氧气,氧气是由氧分子构成的,则空气中含有氧分子,故选项正确。B、氯酸钾是由钾离子和氯酸根离子构成的,不含氧分子,故选项错误。C、过氧化氢是由过氧化氢分子构成的,不含氧分子,故选项错误。D、高锰酸钾是由钾离子和高锰酸根离子构成的,不含氧分子,故选项错误。故选:A。
3.(2020•北京)下列物质含有氧分子的是( )A.O2B.H2O2C.H2CO3D.SO2
【答案】A【解答】解:A、氧气是由氧分子构成的,故选项正确。B、过氧化氢是由过氧化氢分子构成的,不含氧分子,故选项错误。C、H2CO3是由碳酸分子构成的,不含氧分子,故选项错误。D、SO2是由二氧化硫分子构成的,不含氧分子,故选项错误。故选:A。
4.(2020•重庆)下列粒子中,不能直接构成物质的是( )A.原子B.分子C.离子D.中子
【答案】D【解答】解:A、原子可以直接构成物质,如金属是由原子直接构成的,故选项错误。B、分子可以直接构成物质,如氧气属于气态非金属单质,是由氧分子构成的,故选项错误。C、离子可以直接构成物质,如氯化钠是含有金属元素和非金属元素的化合物,氯化钠是由钠离子和氯离子构成的,故选项错误。D、中子是构成原子的一种粒子,中子不能直接构成物质,故选项正确。故选:D。
1微粒的质量很轻,体积很小;
3构成物质的微粒之间有间隔。气>液>固(水特殊) 热胀冷缩&三态变化
微粒在不断运动(温度影响); 任何状态都在运动
4 同种分子化学性质相同;不同种 分子化学性质不同。
实验 分子运动现象的探究
1.实验目的:认识分子的运动。2.实验装置
特别提醒1、大烧杯的作用:防止氨分子扩散到空气中对空气造成污染(或使氨分子局限在一定的空间内运动,浓度增大,实验现象明显)。2、增加一个C烧杯在大烧杯外,能够起到对比作用
3.实验步骤(1)在盛有约20 mL蒸馏水的小烧杯A中加入5~6滴酚酞溶液,搅拌均匀,观察溶液的颜色。(2)从小烧杯A中取少量溶液于试管中,向其中慢慢滴加浓氨水,观察溶液颜色的变化。(3)另取一个小烧杯B,加入约5 mL浓氨水。用一个大烧杯或水槽罩住A、B两个小烧杯(如图所示),观察现象。
5.实验结论:分子在不断地运动。
归纳总结1、气>液>固(水特殊) 热胀冷缩&三态变化是粒子间有间距物质受热膨胀使粒子间的间隔变大,不是粒子的体积变大。例如:水烧开后易把壶盖顶起,是因为受热后水分子间间隔变大;水银温度计受热液柱上升,是因为受热后汞原子间间隔变大。
2.用微粒的观点解释(1)物质的变化:由分子构成的物质在发生物理变化时,构成物质的分子 (填“发生”或“不发生”,下同)变化;(2)发生化学变化时,构成物质的分子 变化。 化学变化的实质:反应物的分子分解为 , 又重新组合形成新的分子。 (3)混合物、纯净物:由分子构成的物质形成的混合物中含有 分子,纯净物中含有 分子。 (4)单质、化合物:由分子构成的物质,单质的分子由 原子构成,化合物的分子由 原子构成。
1.(2020•烟台)宏观辨识与微观探析是化学学科的核心素养之一。下列对宏观事实的微观解释错误的是( )
A.AB.BC.CD.D
【答案】B【解答】解:A、氧气经压缩可以储存在钢瓶中,是因为分子间有间隔,压强增大,分子间的间隔变小,故选项解释正确。B、水电解生成氢气和氧气,是因为水分子分裂成了氢原子和氧原子,然后氢原子、氧原子分别重新组合形成氢分子、氧分子,化学反应前后原子的种类没有发生改变,故选项解释错误。C、一氧化碳和二氧化碳化学性质不同,是因为不同分子性质不同,故选项解释正确.D、氢氧化钠溶液和氢氧化钙溶液具有相似的化学性质,是因为两种溶液中都含有OH﹣,故选项解释正确。故选:B。
2.(2020•黄石)下列对有关事实的解释错误的是( )A.干冰升华﹣﹣分子的体积变大B.冰水共存物属于纯净物﹣﹣冰和水都由水分子构成C.氧化汞受热分解﹣﹣在化学变化中分子可以分为原子D.酒精挥发﹣﹣分子总是在不断运动着
【答案】A【解答】解:A、干冰升华,是因为二氧化碳分子间的间隔增大,故选项解释错误。B、冰水共存物属于纯净物,是因为冰和水都由水分子构成,只含有一种分子,故选项解释正确。C、氧化汞受热分解,是因为氧化汞分子分裂成了汞原子和氧原子,然后氧原子重新组合形成氧分子,大量的氧分子聚集成氧气,汞原子直接聚集成金属汞,该事实说明分子是可以再分的,故选项解释正确。D、酒精挥发,是因为酒精分子总是在不断运动着,运动到空气中去了,故选项解释正确。故选:A。
3.(2020•大连)用微粒的观点解释“墙内开花墙外香”的主要原因是( )A.分子很小B.分子不断运动C.分子之间有间隔D.分子由原子构成
【答案】B【解答】解:墙内开花墙外香,是因为花香中含有的分子是在不断的运动的,向四周扩散,使人们闻到花香。A、由分子的性质可知,墙内开花墙外香的主要原因与分子很小无关,故选项错误。B、由于分子是在不断的运动的,这是造成墙内开花墙外香的主要原因,故选项正确。C、由分子的性质可知,墙内开花墙外香的主要原因与分子之间有间隔无关,故选项错误。D、由分子的性质可知,墙内开花墙外香的主要原因与分子由原子构成无关,故选项错误。故选:B。
4.(2020•柳州)宏观辨识与微观探析是化学核心素养之一。下列对宏观事实的微观推理错误的是( )A.6000L氧气经加压可装入40L的钢瓶中,是因为氧分子变小B.氢气与氧气属于不同物质,是因为它们由不同分子构成C.墙内开花墙外可闻到花香,是因为分子在不断地运动D.碱有相似的化学性质,是因为碱溶液中都含有OH﹣
【答案】A【解答】解:A.6000L氧气经加压可装入40L的钢瓶中,是因为氧分子之间有间隔,在受压时间隔变小,氧分子的体积不变,说法不正确;B.氢气与氧气属于不同物质,是因为它们由不同分子构成,说法正确;C.墙内开花墙外可闻到花香,是因为分子在不断地运动,花香的微粒通过运动分散到周围的空气中去了,说法正确;D.碱有相似的化学性质,是因为碱溶液中都含有OH﹣,说法正确。故选:A。
5.(2020•吉林)对下列现象解释正确的是( )A.汽油挥发﹣﹣分子可分B.花香四溢﹣﹣分子不断运动C.冰雪融化﹣﹣分子很小D.氧气液化﹣﹣分子体积变小
【答案】B【解答】解:A、汽油挥发,是因为汽油分子不断地运动,而不是分子体积变大,故选项解释错误。B、花香四溢,是因为花香中含有的分子是在不断运动的,向四周扩散,使人们闻到花香,故选项解释正确。C、冰雪融化,是因为分子间的间隔变小的缘故,故选项解释错误。D、氧气液化,因为分子间的间隔变小的缘故,故选项解释错误。故选:B。
6.(2020•威海)学习了化学,我们掌握了宏观辨识与微观探析物质的本领。对以下物质的辨别方法及微观解释,不正确的是( )A.用带火星木条辨别氧气与二氧化碳﹣﹣氧分子能助燃,二氧化碳分子不支持燃烧B.用氯化钡溶液辨别硝酸银溶液与硫酸钠溶液﹣﹣银离子与氯离子结合生成氯化银,钡离子与硫酸根离子结合生成硫酸钡C.用燃烧法辨别碳纤维与蚕丝纤维﹣﹣碳纤维由碳原子构成,蚕丝纤维由蛋白质分子构成D.用酸碱指示剂辨别稀盐酸与氢氧化钠溶液﹣﹣盐酸中含有氢离子,氢氧化钠溶液中含有氢氧根离子
【答案】B【解答】解:A.氧气是由氧分子构成的,氧气分子具有助燃性;二氧化碳是由二氧化碳分子构成的,二氧化碳分子不支持燃烧,所以可用带火星木条辨别氧气与二氧化碳,选项说法正确;B.氯化钡溶液中的氯离子与硝酸银溶液中的银离子能结合成氯化银白色沉淀;氯化钡溶液中的钡离子能与硫酸钠溶液中的硫酸根离子结合成硫酸钡白色沉淀,所以不能用氯化钡溶液辨别硝酸银溶液与硫酸钠溶液,选项说法错误;C.碳纤维由碳原子构成,蚕丝纤维由蛋白质分子构成,蚕丝燃烧时产生烧焦羽毛的气味,而碳纤维燃烧时无此气味,可以用燃烧法辨别碳纤维与蚕丝纤维,选项说法正确;D.盐酸中含有氢离子,氢离子能使紫色的石蕊试液变红色,不能使无色酚酞试液变色;氢氧化钠溶液中含有氢氧根离子,氢氧根离子能使紫色的石蕊试液变蓝色,能使无色酚酞试液变红色,所以可用酸碱指示剂辨别稀盐酸与氢氧化钠溶液,选项说法正确。故选:B。
3.原子及其结构(1)原子的构成
归纳总结(1)原子整体是不显电性的。在原子中,核电荷数=质子数=核外电子数=原子序数。(2)不是所有的原子都是由质子、中子和电子三种微粒构成的,如一种氢原子中就没有中子。
(2)原子的核外电子分层排布
特点 1:电子按能量由低到高,由里到外排布。特点 2:“288”
②原子最外层电子数与元素化学性质的关系:
离子的概念:带电荷的原子或原子团
(6)原子和离子的区别和联系
(4)离子的表示方法:在元素符号的右上角用“+”或“-”表示离子的电性,数字表示每个离子所带的电荷数,先写数字后写正负号,当数字为1 时,省略不写,如Na+、Cl-、Al3+、S。(5)离子符号表示的意义:表示离子(或一个离子)例如:Al3+表示 (或一个铝离子)
每个铝离子带3个单位的正电荷
得分巧记判断某微粒是原子还是离子的方法
特别提醒相对原子质量不等于原子的实际质量,它是个比值;原子的实际质量越大,其相对原子质量就越大。
(3)相对原子质量①相对原子质量= , 其单位为“一”,符号为“1”,常省略不写。②相对原子质量≈质子数+中子数。
1.(2020•鞍山)原子核中一定含有的粒子是( )A.中子B.质子C.电子D.质子和电子
【答案】B【解答】解:原子核是由质子和中子构成的,但是中子不一定存在,例如普通氢原子不含有中子,故原子核中一定含有质子。故选:B。
2.(2020•盘锦)如图所示的原子,在化学反应中易得到电子的是( )
【答案】D【解答】解:A、最外层的电子数是1,小于4,在化学反应中失去到电子,故A不符合题意;B、最外层的电子数是8,达到了相对稳定结构,在化学反应中不易得失电子,故B不符合题意;C、最外层的电子数是2,小于4,在化学反应中失去到电子,故C不符合题意;D、最外层的电子数是7,大于4,在化学反应中易得到到电子,故D符合题意。故选:D。
3.(2020•兴安盟)如图为某粒子结构示意图,下列说法错误的是( )
A.该粒子属于非金属元素B.该粒子核外电子数为17C.该粒子具有3个电子层D.在化学反应中,该元素原子易得电子形成Cl﹣
【答案】B【解答】解:A.该元素的核内质子数为17,为氯元素,属于非金属元素,故选项说法正确;B.该粒子核外电子数是2+8+8=18,故选项说法错误;C.由图示可知,该粒子核外有3个电子层,故选项说法正确;D.该粒子是原子得到1个电子得到的,其原子的最外层电子数为7,在化学反应中易得到1个电子而形成带1个单位正电荷的阴离子,其离子符号为Cl﹣,故选项说法正确。故选:B。
4.(2020•金昌)“宏观辨识与微观探析”是化学学科的核心素养之一。如图是四种粒子的结构示意图,下列说法不正确的是( )
A.③④属于同种元素B.①④均表示离子C.③④化学性质相似D.②和③可形成化合物AlCl3
【答案】C【解答】解:A.由粒子结构示意图可知,③④的质子数相同,所以属于同种元素,选项说法正确;B.①④中,质子数均不等于核外电子数,所以均表示离子,选项说法正确;C.③的最外层有7个电子,在化学反应中易得到一个电子;而④的最外层有8个电子,属于稳定结构,二者化学性质不同,选项说法错误;D.②的质子数为13,是铝元素,在化合物中显+3价,③的质子数为17,是氯元素,在化合物中显﹣1价,二者形成化合物的化学式为AlCl3,选项说法正确。故选:C。
1.元素(1)定义:元素是_______(即核电荷数)相同的一类原子的总称。
易失分点理解元素概念的要点(1)元素属于宏观概念,只讲种类,不讲个数,表示物质的组成;(2)元素的种类是由质子数或核电荷数决定;(3)在化学变化中,元素的种类不变,原子的种类也不变。
(3)各元素的含量分布
①地壳中含量(质量分数)居前五位的元素依次是:氧、硅、铝、铁、钙,含量最多的金属元素是________。②空气中含量居前两位的元素依次是:氮、氧。③人体中含量(质量分数)居前五位的元素依次是:氧、碳、氢、氮、钙。④海水中含量最多的元素是:________。
(4)元素与原子的区别和联系:
2.元素符号(1)书写只有一个字母表示的,一般大写;有两个字母表示的元素符号,第一个字母大写,第二个字母必须小写。(2)元素符号表示的意义 a.宏观意义:表示一种元素。b.微观意义:表示这种元素的一个原子。c.金属、稀有气体和部分非金属的元素符号,还表示该种元素所组成的单质。
得分巧记(1)如果元素符号前面加上具体数字,就只表示该原子的个数,只具有微观意义;(2)对于用元素符号表示的化学式,它的含义还包括物质及物质的组成,且该物质由原子构成。
3.元素周期表(1)元素周期表中每一个横行叫一个周期,共 个周期;每一个纵行叫一个族(8、9、10三个纵行共同组成一个族)。 (2)元素周期表中简单的规律:同一横行电子层数相同,最外层电子数由左向右递增(主族元素);同一纵行最外层电子数相同,电子层数由上向下递增(主族元素)。
(3)从元素单元格中获取的信息①原子序数:位于单元格左上角,且原子序数=质子数=核电荷数=原子核外电子数。②元素符号:位于单元格右上角。③元素名称:位于单元格正中间,可根据偏旁部首判断元素分类。④相对原子质量:位于单元格正下方,单位为“一”,符号为“1”,常省略不写。相对原子质量≈质子数+中子数。
1.(2020•柳州)奶制品、豆类、虾皮等食物中含钙丰富,是日常饮食中钙的较好来源,这里的“钙”指( )A.钙离子B.钙原子C.钙元素D.钙单质
【答案】C【解答】解:奶制品、豆类、虾皮等食物中含钙丰富,这里的钙是指钙元素,与具体形态无关。故选:C。
2.(2020•金昌)2020年1月14日,C919大型客机第二架机迎来了进入2020年后的第一次飞行。C919部分机身采用了新型的铝锂合金,铝锂合金中的铝元素与锂元素的本质区别是( )A.相对原子质量不同B.原子的质子数不同C.原子的电子数不同D.原子的中子数不同
【答案】B【解答】解:元素是质子数(即核电荷数)相同的一类原子的总称,决定元素种类的是质子数(即核电荷数),不同种元素最本质的区别是核电荷数(即核内质子数)不同,故铝(Al)元素与锂(Li)元素的本质区别是质子数不同。故选:B。
3.(2020•柳州)如图为地壳中的元素含量图,地壳中含量最多的元素是( )
A.铝B.铁C.氧D.硅
【答案】C【解答】解:由图中表示的地壳里所含各种元素的质量分数可知:地壳中含量最多的元素是氧。故选:C。
1.(2020•大连)我国的5G通信芯片主要由氮化镓材料制成,如图是镓元素在元素周期表中的相关信息。下列说法错误的是( )
A.镓属于金属元素B.镓原子的质子数是31C.镓原子质量是69.72gD.镓原子核外有31个电子
【答案】C【解答】解:A、镓元素的汉字是金字旁,属于金属元素,说法正确;B、在原子中,原子序数=质子数,由元素周期表的信息可知,镓元素的原子序数为31,因此镓原子的质子数也为31,说法正确;C、镓原子的相对原子质量为69.72,而不是原子的实际质量为69.72g,说法错误;D、在原子中,原子序数=核外电子数,由元素周期表的信息可知,镓元素的原子序数为31,因此镓原核外有31个电子,说法正确;故选:C。
最新九年级化学人教版上册 第三单元 物质构成的奥秘 复习课件: 这是一份最新九年级化学人教版上册 第三单元 物质构成的奥秘 复习课件
最新九年级化学人教版上册 第三单元 物质构成的奥秘 单元复习: 这是一份最新九年级化学人教版上册 第三单元 物质构成的奥秘 单元复习,共36页。PPT课件主要包含了化学性质,运动越快,间隔越大,没有发生改变,发生了改变,易错微博,化学变化,核外电子,质子数,核外电子数等内容,欢迎下载使用。
初中化学人教版九年级上册第三单元 物质构成的奥秘综合与测试复习ppt课件: 这是一份初中化学人教版九年级上册第三单元 物质构成的奥秘综合与测试复习ppt课件,共39页。PPT课件主要包含了复习目标,原子构成的规律,练一练,物质的构成,再试一试,稀有气体,考点三,考点四,考点五等内容,欢迎下载使用。













