

广东省广州市华南师大附中2021届高三上学期综合测试(二)化学(含答案)
展开华南师大附中高三综合测试(二)
化 学
满分100分,考试时间75分钟
注意事项:
1.答卷前,请务必用黑色字迹的钢笔或签字笔将自己的班级、姓名和考号填写在答题卡和答卷上。
2.选择题在选出答案后,用2B铅笔把答题卡上对应题目选项的答案涂黑,如需改动,用橡皮擦干净后,再选涂其他答案,答案不能答在试卷上。
3.非选择题必须用黑色字迹钢笔或签字笔作答,答案必须写在答卷各题目指定区域内相应位置上;如需改动,先划掉原来的答案,再写上新答案;不准使用铅笔和涂改液。不按要求作答的答案无效。
4.考生必须保持答题卡的整洁。考试结束后,将答题卡交回。
可能用到的相对原子质量:H 1 C12 N14 O 16 F 19 Na23 Al27 Si28 Ni59
一、单项选择题(本大题共16小题,1~10每小题2分,11~16每小题4分,满分44分。在每小题列出的四个选项中只有一项符合题目要求)
1.下列说法错误的是
A.中国天眼传输信息用的光纤材料的主要成分是硅
B.港珠澳大桥用到的合金籾料,具有强度大、密度小、耐腐蚀等性能
C.国产大飞机C919用到的氮化硅陶瓷是新型无机非金属材料
D.蛟龙号潜水器用到钛合金,22号钛元素属于过波元素
2.下列化学物质在实际生产生活和科技等方面的应用错误的是
A.NaHCO3和Al(OH)3都能用来做抗酸药
B.漂白粉不能与洁厕灵(主要成分为HCl)混用
C.明矾可用于水的杀菌消毒
D.常温下,液氯通常储存在钢瓶中
3.下列有关物质分类或归类中,正确的是
A.混合物:水玻璃、漂白粉、冰水混合物
B.化合物:CaCl2、NaOH、HD
C.电解质:明矾、石膏、盐酸溶液
D.同素异形体:C60、金刚石、石墨
4.下列关于元素化合物的化学用语错误的是
A.O2-的结构示意图:
B.中子数为18的氯原子:
C.NH4Cl的电子式:
D.SO2氧化H2S生成单质硫:
5.NA表示阿伏加德罗常数的值。下列叙述正确的是
A.4.6 gNO2和N2O4混合气体中N原子的数目为0.1NA
B.标准状況下,2.24L己烷中共价键的数目为1.9NA
C.在0.1 mol/L的Na2CO3溶液中,阴离子总数一定大于0.1NA
D.将0.1mol Cl2通入到足量的水中,溶液中Cl-、HClO、ClO-微粒总数为0.2NA
6.反应,被氧化的NH3与被还原的Cl2的物质的量之比为
A.2:3 B. 8:3 C. 6:3 D. 3:2
7.实验室需配制480mL 1mol·L-1NaOH溶液,下列叙述正确的是
A.转移液体时,玻璃棒下端应紧靠容量瓶口
B.用托盘天平称量19.2gNaOH固体
C.摇匀后发现液面略低于刻度线,应再加水到达刻度线
D.定容时若俯视刻度线观察液面,会使所配制的NaOH溶液的浓度偏高
8.下列实验操作正确的是
A.将氯化铝溶液蒸干制备氯化铝固体
B.用Ca(OH)2溶液鉴别Na2CO3溶液和NaHCO3溶液
C.用饱和NaHCO3溶液除去CO2中的SO2
D.在FeCl3溶液加入NaOH溶液并煮沸得到Fe(OH)3胶体
9.在指定条件下,下列各组离子一定能大量共存的是
A.Na+、Fe2+、ClO-、 B.Fe3+、Mg2+、、Br-
C.Ca2+、K+、、 D.OH-、、Cl-、HS-
10.下列用于解释事实的离子方程式正确的是
A. NaOH与过量SO2溶液反应:
B.向Ba(OH)2溶液中加入稀硫酸:
C.硫酸铜溶液中滴加稀氨水:
D.醋酸除水垢:
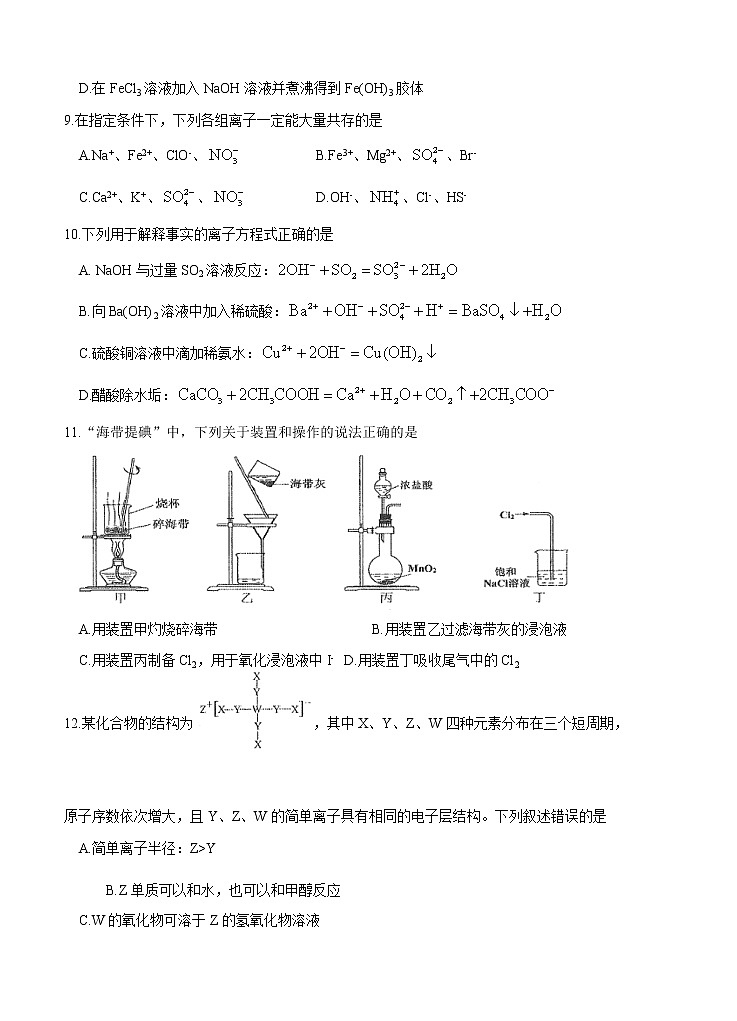
11.“海带提碘”中,下列关于装置和操作的说法正确的是
A.用装置甲灼烧碎海带 B.用装置乙过滤海带灰的浸泡液
C.用装置丙制备Cl2,用于氧化浸泡液中I- D.用装置丁吸收尾气中的Cl2
12.某化合物的结构为 ,其中X、Y、Z、W四种元素分布在三个短周期,
原子序数依次增大,且Y、Z、W的简单离子具有相同的电子层结构。下列叙述错误的是
A.简单离子半径:Z>Y
B.Z单质可以和水,也可以和甲醇反应
C.W的氧化物可溶于Z的氢氧化物溶液
D.ZX和Z2Y所含化学键类型完全相同
13.如表所示为部分短周期元素的原子半径及主要化合价,根据表中信息判断以下叙述正确的是
元素代号 | A | B | C | D | E |
原子半径/nm | 0.160 | 0.143 | 0.102 | 0.071 | 0.099 |
主要化合价 | +2 | +3 | +6、-2 | -1 | -1 |
A.A、B简单离子半径大小关系为:B3+>A2+
B.简单气态氢化物沸点:D>E
C.简单气态氢化物的稳定性:D<C
D.最高价氧化物对应的水化物的酸性:C>E
14.下列实验中,对应的现象以及结论都正确且两者具有因果关系的是
选项 | 实验 | 现象 | 结论 |
A | 将稀硝酸加入过量铁粉中,充分反应后滴加KSCN溶液 | 有气体生成,溶液呈血红色 | 稀硝酸将Fe氧化为Fe3+ |
B | 将铜粉加1.0mol·L-1Fe2(SO4)3溶液中 | 溶液变蓝、有黑色固体出现 | 金属铁比铜活泼 |
C | SO2通入到酸性髙猛酸钾溶液中 | 紫红色褪去 | 二氧化硫具有漂白性 |
D | 将浓硫酸滴到蔗糖表面 | 固体变黑膨胀 | 浓硫酸有脱水性和强氧化性 |
15.对实验I~IV的实验现象预测正确的是
A.实验I:液体分层,下层呈无色
B.实验II:烧杯中先出现白色沉淀,后溶解
C.实验III:试管中有红色沉淀生成
D.实验IV:放置一段时间后,饱和CuSO4溶液中出现蓝色晶体
16.厌氧氨化法(Anammox)是一种新型的氨氮去除技术。下列说法中错误的是
A.联氨(N2H4)中含有极性键和非极性键
B.过程II中N2H4发生了氧化反应
C.过程IV中发生了氧化反应
D.过程Ⅰ中,参与反应的与NH2OH的物质的量之比为1:1
二、非选择题(共4小题,共56分)
17.氯气与碱溶液反应,在低温和稀碱溶液中主要产物是ClO-和Cl-,在75℃以上和浓碱溶液中主要产物是和Cl-。研究小组用如下实验装置取氯酸钾(KClO3),并测定其纯度。
回答下列问题;
(1)检查装置气密性后,添加药品,待装置III水温升至75℃开始反应。
①装置I的作用是制备__________,反应的化学方程式为__________。
②若取消装置II,对本实验的影响是__________。
③实验结束,拆解装置I前为了防止大量氯气逸出,可釆取的措施是__________。
④从装置III的试管中分离得到KClO3粗产品,其中混有的杂质是KClO和__________。
(2)已知碱性条件下,ClO-有强氧化性,而氧化性很弱。设计实验证明“碱性条件下,H2O2能被ClO-氧化,而不能被氧化”:_________(写出实验操作及现象)。
(3)为测定产品KClO3的纯度,进行如下实验:
步骤1:取2.45 g样品溶于水配成250 mL溶液。
步骤2:取25.00mL溶液于锥形瓶中,调至pH=10,滴加足量H2O2溶液充分反应,然后煮沸溶液1~2分钟,冷却。
步骤3:加入过量KI溶液,再逐滴加入足量稀硫酸。()
步骤4:加入指示剂,用0.5000mol·L-1 Na2S2O3标准溶液滴定至终点,消耗标准溶液20.00mL。()
①步骤2的目的是_________。写出煮沸时反应的化学方程式__________________。
②样品中KClO3的质量分数为_________。(KClO3式量:122.5)
18.废旧锂离子电池的回收利用意义重大,其正极废料的主要成分是LiCoO2、铝、炭黑及其他杂质,回收利用的流程如下:
已知“溶液A”中主要金属离子是Co2+、Li+,还含有少量Fe3+、Al3+。
(1)步骤①中铝溶解的离子方程式为_______________,固体X的成分是_______________。
(2)步骤②中LiCoO2固体溶解的化学方程式为:______________________________,该反应的还原剂是_______________。
(3)母液中含量最大的三种离子是_______________。
(4)(NH4)2C2O4是一种化学实验室常用的试剂,预测其溶解性_______________(填“可溶于水”或“不溶于水”)。一定温度下,(NH4)2C2O4固体可分解出NH3、CO等物质,写出其分解的化学方程式_______________________________。
19.氮化铝(AlN)是一种新型无机非金属材料。为了分析某AlN样品(样品中的杂质不与氢氧化钠溶液反应)中AlN的含量,某实验小组设计了如下两种实验方案。
已知:
【方案1】取一定量的样品,用以下装置测定样品中AlN的纯度(夹持装置已略去)。
(1)NH3的电子式是______________;C装置中球形干燥管的作用是______________。
(2)完成以下实验步骤:组装好实验装置,首先______________,再加入实验药品。接下来的实验操作是:测定C装置反应前的质量,关闭K1,打开K2,打开分液漏斗活塞,加入NaOH浓溶液,至不再产生气体。打开K1,通入氮气一段时间,测定C装置反应后的质量。通入氮气的目的是______________。
(3)若去掉装置B,则导致测定结果______________(填“偏高”“偏低”或“无影响”)。由于上述装置还存在缺陷,导致测定结果偏高,请提出改进意见:_________________________。
【方案2】按以下步骤测定样品中AlN的纯度:
(4)步骤②生成沉淀的离子方程式为______________。
(5)步骤③的操作是______________。AlN的纯度是______________(用m1、m2表示)。
20.一种磁性材料的磨削废料(含镍质量分数约21%)主要成分是铁镍合金,还含有铜、钙、镁、硅的氧化物。由该废料制备纯度较高的氢氧化镍,工艺流程如下:
回答下列问题:
(1)合金中的镍难溶于稀硫酸,“酸溶”时除了加入稀硫酸,还要边搅拌边缓慢加入稀硝酸,反应有生成。写出金属镍溶解的离子方程式_______________,“酸溶”时产生的废渣主要成分为____________________。
(2)“除铁”时H2O2的作用是____________________,为了证明添加的H2O2已足量,应选择的试剂是____________________(填“铁氰化钾”或“硫氰化钾”的化学式)溶液。黄钠铁矾有沉淀颗粒大、沉淀速率快、容易过滤等特点,已知x=1、y=3、m=2,则n=___________,写出“除铁”中加入Na2CO3时反应的离子方程式_____________。
(3)“除铜”时,反应的离子方程式为________________,若用Na2S代替H2S除铜,优点是________________________。
(4)已知“除钙镁”过程在陶瓷容器中进行,NaF的实际用量为理论用量的1.1倍,用量不宜过大的原因是_____________________。
(5)100 kg废料经上述工艺制得Ni(OH)2固体的质量为31 kg,则镍回收率的计算式为_____________________。








