











初中化学鲁教版九年级下册到实验室去:探究酸和碱的化学性质优质课练习题习题课件ppt
展开2.通式:酸 + 碱 = 盐 + 水
1.定义:酸与碱相遇时酸中解离出的H+与碱中解离出的OH-生成水而其他离子生成盐的反应叫做中和反应。
3.反应的实质:H+ + OH- = H2O
注意:有盐和水产生的反应不一定是中和反应!
4.所属反应类型:中和反应属于复分解反应的一种。
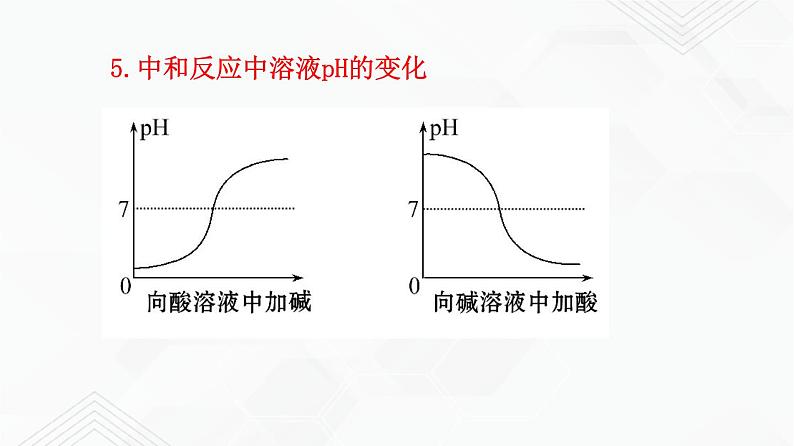
5.中和反应中溶液pH的变化
6.酸碱中和反应在日常生活、工农业生产、科学实验中的应用
(1)应用于医药卫生——碱性药物[Al(OH)3]中和胃酸过多
(2)改变土壤的酸碱性
(4)调节溶液的酸碱性
【回顾】前面我们已经学过了酸与碱的性质,想一想,酸和碱分别能与哪些物质发生反应?
酸+紫色石蕊试液 变红
酸+无色酚酞试液 不变色
酸+金属 盐和氢气
酸+金属氧化物 盐和水
酸+盐 新盐和新酸
碱+紫色石蕊试液→变蓝
碱+无色酚酞试液→变红
碱+非金属氧化物→盐+水
今天,我们将自己动手操作,来探究一下酸和碱的各项化学性质。
1、通过实验进一步认识酸碱的化学通性。2、初步学会使用酸碱指示剂和pH试纸检验溶液的酸碱性。3、初步学会运用间接观察法收集证据,感悟探究物质化学性质的一般思路和方法。
1.所需仪器:试管、烧杯、胶头滴管、点滴板、玻璃片、白瓷板、玻璃棒
(1)石蕊试液、酚酞试液、pH试纸;(2)稀盐酸、稀硫酸、氢氧化钠溶液、氢氧化钙溶液(澄清石灰水);(3)白醋、柠檬汁、肥皂水、蔗糖水、自来水,镁条、石灰石、2%氯化铜溶液、生锈铁钉、2%碳酸钠溶液;
注意:你在开始实验之前需要了解:
(1)用胶头滴管取用液体和向试管中滴加液体的操作方法;
取用前:先清洗,然后将橡胶头捏扁,插入待取液。
取液后:胶头向上不能横放或倒放。
滴加时:垂直悬空在容器的正上方。使用后:立即清洗(滴瓶上的胶头滴管用后不需要清洗)。
(2)用pH试纸测定溶液酸碱性的方法:
使用方法: 将石蕊试纸放在表面皿上,用玻璃棒蘸取少量试液滴在石蕊试纸上,然后观察试纸颜色的变化。
注意:玻璃棒用后要立即冲洗擦干,再去蘸取其他溶液。
即使是稀的酸、碱溶液,对皮肤或衣物也有腐蚀性,一定要注意保护眼睛(例如佩戴护目镜)。在取用酸、碱溶液时要小心,如果不慎洒落在皮肤或衣物上,应立即用水冲洗;万一溅到眼睛里,要立即用大量的水冲洗,同时报告老师。
1. 酸、碱与指示剂作用
【实验步骤】(1)在洁净的点滴板上或小试管中分别滴加5〜6滴稀盐酸、稀硫酸、白醋、柠檬汁和自来水。然后向这5种液体中分别滴加1〜2滴石蕊试液,观察溶液颜色变化情况。
(2)将石蕊试液换成酚酞试液,重复上述实验。观察溶液颜色变化情况。
(3)在干燥、洁净的玻璃板或白瓷板上放5片pH试纸,用玻璃棒分别蘸取5种待测液体,点到pH试纸上,将试纸显示的颜色与标准比色卡对照,读出溶液的pH。
酸溶液的pH小于7,可使紫色石蕊变为红色,不能使酚酞变色。
【实验步骤】(4)将上述待测液换成氢氧化钠溶液、氢氧化钙溶液、肥皂水、蔗糖水和食盐水,重复上述实验步骤。
碱(性)溶液的pH大于7,可使石蕊变蓝色,使酚酞变红色。
在2支试管中分别加入1〜2 mL稀盐酸和稀硫酸,用pH试纸测定其pH;然后向试管中分别滴加氢氧化钠溶液,同时测定溶液的pH,直到pH等于7时,停止滴加氢氧化钠溶液。
HCl+NaOH=NaCl+H2O
H2SO4+NaOH=Na2SO4+H2O
3. 酸、碱的其他化学性质
(1)在4支试管中分别加入镁条、石灰石、生锈铁钉、碳酸钠溶液,然后向试管中分别滴加1〜2 mL稀盐酸,观察现象。将稀盐酸换成稀硫酸,重复上述实验步骤并观察现象。
酸可以与活泼金属、金属氧化物和一些盐反应。涉及到的反应方程式如下:
Mg+2HCl=MgCl2+H2↑
Mg+H2SO4=MgSO4+H2↑
Fe2O3+6HCl=2FeCl3+3H2O
Fe2O3+3H2SO4=Fe2(SO4)3+3H2O
Na2CO3+2HCl=2NaCl+H2O+CO2↑
CaCO3+2HCl=CaCl2+H2O+CO2↑
CaCO3+H2SO4=CaSO4+H2O+CO2↑
Na2CO3+H2SO4=Na2SO4+H2O+CO2↑
上述反应涉及到的化学方程式
(2)在3支试管中分别加入1〜2 mL氯化铜溶液、碳酸钠溶液和生锈铁钉,然后向试管中分别滴加1〜2 mL氢氧化钠溶液,观察现象。将氢氧化钠溶液换成氢氧化钙溶液,重复上述实验步骤并观察现象。
碱可以与一些盐反应,但不能与金属氧化物反应。涉及到的化学方程式如下:
2NaOH+CuCl2=Cu(OH)2↓+2NaClCa(OH)2+CuCl2=Cu(OH)2↓+CaCl2Ca(OH)2+Na2CO3=2NaOH+CaCO3↓
上述反应涉及到的化学方程式:
1. 实验中你使用的是试管还是点滴板?你认为使用哪种仪器更方便?
2. 你的探究过程顺利吗?有哪些成功的经验要与同伴分享?有哪些教训值得大家引以为戒?
用点滴板更加方便,且节约药品
顺利,滴定过程要逐滴加入,pH接近7时,要慢慢滴入。用酸或碱时要小心,溅落在皮肤或眼睛上,有腐蚀作用。
1. 酸、碱与指示剂作用——使指示剂变色
3. 酸、碱的其他化学性质 酸+金属=盐+氢气 酸+金属氧化物=盐+水 酸+盐=新酸+新盐 碱+非金属氧化物=盐+水 碱+盐=新碱+新盐
2. 酸碱中和反应:酸+碱=盐+水
考点一:酸和碱与酸碱指示剂的反应
【典型例题1】(2019春•永春县校级月考)大致测定某溶液是酸性还是碱性,要采取( )①石蕊试液 ②酚酞试液 ③石蕊试纸 ④pH试纸.A.只有①②B.只有①②③ C.只有①④D.以上都可以
【迁移训练1】(2019秋•慈溪市期中)某溶液可使酚酞试液变红色,则该溶液会使石蕊试液( )A.变蓝B.变紫C.变红D.不变色
【典型例题2】(2019•徐汇区一模)向氢氧化钠溶液中滴加几滴酚酞后,在滴入盐酸至过量,溶液颜色变化顺序正确的是( )A.无色﹣紫色﹣蓝色B.红色﹣无色﹣无色C.蓝色﹣紫色﹣红色D.红色﹣无色﹣红色
【迁移训练2】(2019•泰安一模)室温下,将稀盐酸慢慢滴入装有氢氧化钠溶液的烧杯中,利用温度计测出烧杯中溶液的温度,绘制出溶液温度随加入盐酸的质量而变化的曲线如图所示。下列说法错误的是( )
A.盐酸与氢氧化钠溶液发生的中和反应是放热反应B.在A处溶液中加入石蕊,溶液呈蓝色C.B处溶液中存在的粒子是Na、Cl﹣D.B到C的过程中溶液的pH逐渐减小
考点三:酸和碱的其他反应
【典型例题3】(2019•滨江区二模)进行如下实验,研究物质的性质。下列说法正确的是( )
A.产生气泡现象的实验有②和⑤B.溶液变色现象的实验有④和⑤C.由实验②和⑤,可证明在金属活动性顺序中Mg在Fe前D.实验③是小苏打治疗胃酸过多的反应
【迁移训练3】(2019•达州中考)甲、乙两组同学为探究氢氧化钙的化学性质,分别做了如下相同的四个实验:
请回答下列问题:(1)试管D中的现象是 。
澄清石灰水变浑浊,有白色沉淀生成
(2)以上实验中,能发生反应但无明显现象的化学方程式 。【继续探究】实验结束后,甲、乙两组同学分别将本组A、B、C、D四支试管中的物质各倒入一个洁净的大烧杯中,充分反应后静置,发现:
①甲组烧杯底部有白色沉淀,上层清液为无色。则上层清液中一定含有的溶质是 (指示剂除外),可能含有的溶质是 。
Ca(OH)2+2HCl=CaCl2+2H2O
②乙组烧杯底部有白色沉淀,上层清液为红色,则上层清液中一定没有的离子是 。【拓展延伸】甲、乙两组同学共同讨论后一致认为两个烧杯底部的白色沉淀为同一物质,请写出本实验过程中产生该白色沉淀的化学方程式 (写一个即可)。
Ca(OH)2+Na2CO3=CaCO3↓+2NaOH
初中化学鲁教版九年级下册第三节 化学与农业生产精品练习题习题课件ppt: 这是一份初中化学鲁教版九年级下册第三节 化学与农业生产精品练习题习题课件ppt,文件包含专题113化学与农业生产讲课件-2019-2020学年九年级化学下册同步精品课堂鲁教版共38张PPTpptx、专题113化学与农业生产练原卷版docx、专题113化学与农业生产练解析版docx等3份课件配套教学资源,其中PPT共38页, 欢迎下载使用。
鲁教版九年级下册第二节 化学与材料研制精品练习题习题课件ppt: 这是一份鲁教版九年级下册第二节 化学与材料研制精品练习题习题课件ppt,文件包含专题112化学与材料研制讲课件-2019-2020学年九年级化学下册同步精品课堂鲁教版共35张PPTpptx、专题112化学与材料研制练原卷版docx、专题112化学与材料研制练解析版docx等3份课件配套教学资源,其中PPT共35页, 欢迎下载使用。
初中化学鲁教版九年级下册第九单元 金属到实验室去 探究金属的性质评优课练习题习题ppt课件: 这是一份初中化学鲁教版九年级下册第九单元 金属到实验室去 探究金属的性质评优课练习题习题ppt课件,文件包含第9单元到实验室去探究金属的性质讲-2019-2020学年九年级化学下册同步精品课堂鲁教版共26张PPTpptx、第九单元到实验室去探究金属的性质练原卷版docx、第九单元到实验室去探究金属的性质练解析版docx等3份课件配套教学资源,其中PPT共26页, 欢迎下载使用。













