




所属成套资源:2021春中考总复习科粤版化学知识点总结PPT课件+测试
2021春中考总复习科粤版化学知识点总结 第八章 常见的酸、碱、盐 课件+测试
展开
这是一份2021春中考总复习科粤版化学知识点总结 第八章 常见的酸、碱、盐 课件+测试,共21页。PPT课件主要包含了指示剂,变红色,变蓝色,不变色紫色,不变色无色,~14,玻璃棒,标准比色卡,浓硫酸,用玻璃棒搅拌等内容,欢迎下载使用。
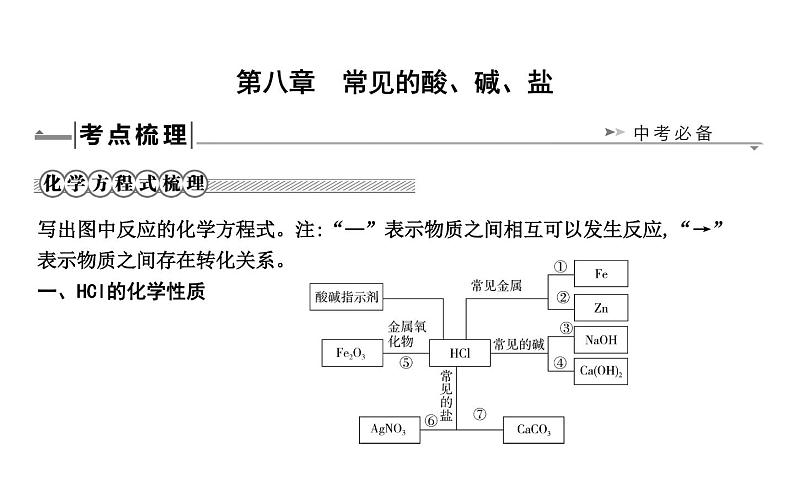
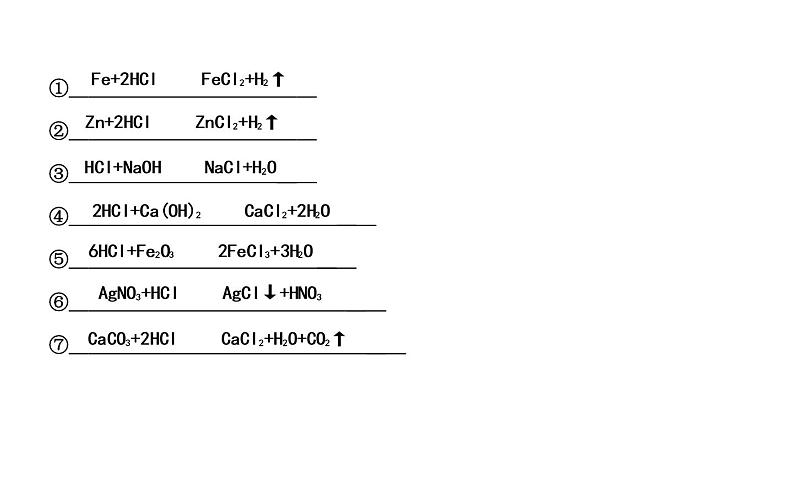
① ② ③ ④ ⑤ ⑥ ⑦
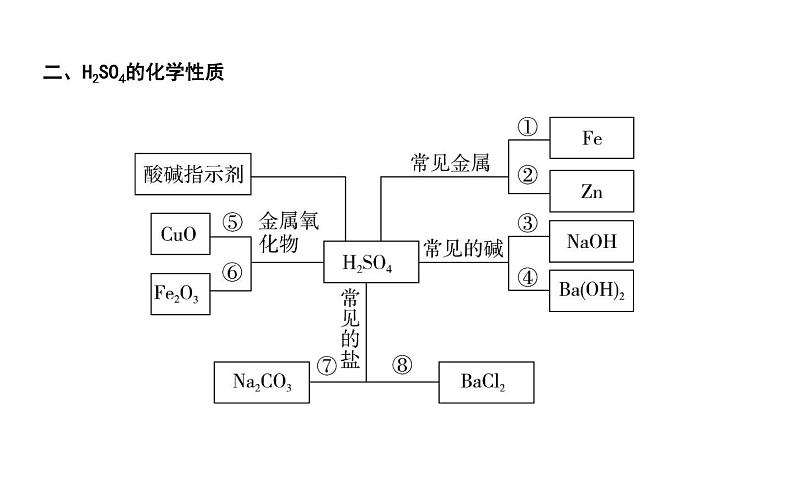
二、H2SO4的化学性质
① ② ③ ④ ⑤ ⑥ ⑦ ⑧
三、NaOH的化学性质
① ② ③ ④
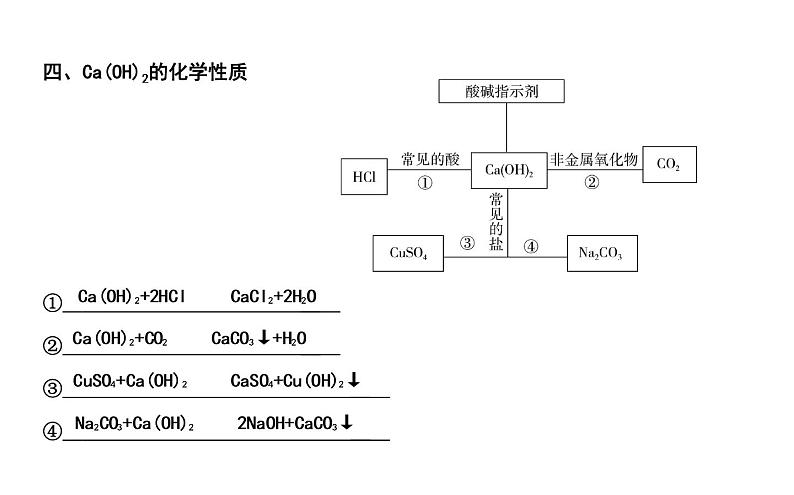
四、Ca(OH)2的化学性质
① ② ③ ④
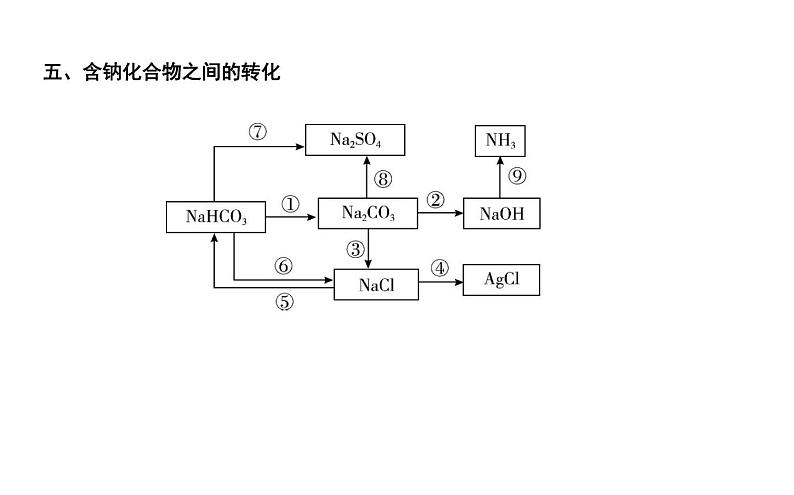
五、含钠化合物之间的转化
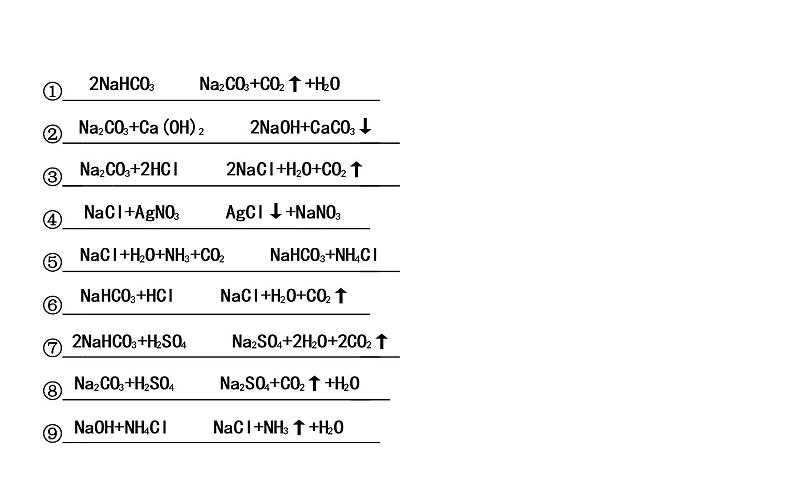
① ② ③ ④ ⑤ ⑥ ⑦ ⑧ ⑨
六、含钙化合物之间的转化
① ② ③ ④ ⑤ ⑥
考点一:溶液的酸碱性(常考点)
1.酸碱指示剂与溶液的酸碱性(1)酸碱指示剂:能跟酸性溶液或碱性溶液起作用而显不同颜色的物质叫做酸碱指示剂,简称 。
(2)紫色石蕊溶液、无色酚酞溶液是常见的两种酸碱指示剂。它们与酸性、碱性和中性溶液作用时显示的颜色见下表:
2.检测溶液酸碱性强弱的程度(1)溶液的酸碱度是指溶液的酸碱性强弱程度。(2)表示方法:用 来表示,pH的范围一般在 ,如下图。pH=7时,溶液呈中性,pH7时,溶液呈碱性。与pH=7相比,pH数值越大,溶液的 越强;pH数值越小,溶液的 越强。
(3)测定溶液pH的方法:测定溶液的酸碱度通常用pH试纸粗略测量。测定方法:①在洁净的表面皿(或小烧杯、点滴板)上放一片pH试纸。②用干燥的 蘸取(或用干燥的滴管吸取)待测液,将粘附在玻璃棒上的溶液轻轻涂抹(如用滴管,则滴一滴)在pH试纸上。③将试纸显示的颜色与 比较便知溶液的pH。
【拓展思考1】 (1)是酸碱指示剂使酸、碱溶液变色吗?答案:不是。酸或碱的溶液使指示剂变色而不是指示剂使酸、碱溶液变色。(2)pH试纸用蒸馏水润湿后对测量结果有什么影响?答案:若待测溶液是酸性溶液,则酸性减弱,pH增大;若待测溶液是碱性溶液,则碱性减弱,pH减小;若待测溶液是中性溶液,则pH无变化。
考点二:常见的酸和碱(常考点)
1.常见的酸(1)常见酸的物理性质及用途酸的种类不少,其中最重要的是“三酸”:盐酸、硫酸和硝酸。
(2)浓硫酸的特性①强脱水性:浓硫酸能很快使蔗糖、纸张等脱水,变成碳。②强腐蚀性:浓硫酸对衣物、皮肤等都有强腐蚀性。③强吸水性:浓硫酸有强吸水性,据此,浓硫酸可用作干燥剂。 ④浓硫酸的稀释:稀释浓硫酸时,一定要把 沿着容器壁慢慢注入 里,并不断 ,切不可 。
由于水的密度较浓硫酸小,当水滴入浓硫酸,浓硫酸溶解时会产生大量热使水立即沸腾,带着硫酸液滴向四周飞溅,十分危险。
(3)稀盐酸、稀硫酸的化学性质①与指示剂反应酸溶液能使紫色石蕊溶液 ,使无色酚酞溶液 。 ②与较活泼金属反应,例如铁与盐酸:(写化学方程式,下同) ; 锌与稀硫酸: 。
③与某些金属氧化物反应,例如氧化铜与盐酸: ; 氧化铁和硫酸: 。 ④与碱反应,例如盐酸与氢氧化铜: ; 硫酸与氢氧化钡: 。 ⑤与某些盐反应,例如氯化钡与硫酸: ; 硝酸银与盐酸: 。
【拓展思考2】 (1)当把浓盐酸和浓硫酸都敞口放置于空气中时,两溶液的质量怎样变化?溶质质量分数呢?答案:浓盐酸有挥发性,敞口放置时因氯化氢挥发,溶液中溶质质量减小,溶液质量减小,溶质质量分数减小;浓硫酸有吸水性,溶剂质量增大,溶液质量增大,溶质质量分数减小。(2)浓硫酸可以做干燥剂是利用了什么性质?哪些气体可以用浓硫酸干燥?答案:浓硫酸具有吸水性,因而可以用于除去某些气体中的水分;能被浓硫酸干燥的气体必须不与浓硫酸反应,如浓硫酸可以干燥H2、O2、CO2、CO等气体。
2.常见的碱(1)常见的碱及其用途
(2)碱的化学性质①能和酸碱指示剂反应使紫色石蕊溶液 ,使无色酚酞溶液 。 ②能和某些非金属氧化物反应。例如向澄清石灰水中通入二氧化碳: 。 氢氧化钠固体暴露在空气中: 。
③能和酸发生中和反应。例如氢氧化钠与盐酸反应: 。④能和部分盐反应(只有可溶性碱和可溶性盐的溶液才能反应)。例如NaOH溶液与CuSO4溶液: 。 (3)氢氧化钠、氢氧化钙变质的探究(详见常考实验突破十)0
考点三:酸和碱的反应(常考点)
1.中和反应(详见常考实验突破十一)(1)概念:酸跟碱生成 的反应。 (2)表达式:酸+碱 盐+水。(3)实质(中和反应):酸中的 和碱中的 结合生成水的过程。 2.中和反应的应用(1)医药应用。(2)改良土壤的酸碱性。(3)废水处理。(4)调节溶液的酸碱性。
【拓展思考3】 (1)凡是生成盐和水的反应一定是中和反应吗?答案:不一定。例如酸和某些金属氧化物、碱和某些非金属氧化物反应都生成盐和水,但不是中和反应。(2)复分解反应一定是中和反应吗?答案:不一定。复分解反应包括中和反应,即中和反应一定是复分解反应,但复分解反应不一定是中和反应。
考点四:常见的盐及化学肥料(常考点)
1.常见的盐(1)盐的概念:是指一类组成含有 离子[或铵根离子( )]和 离子的化合物。 (2)常见盐的性质及用途
(3)盐的化学性质① (金属1比金属2活泼,金属不能是钾、钙、钠)。②盐+酸→新盐+新酸。③ (反应物需都可溶,且满足复分解反应的条件)。 ④ (反应物需都可溶,且满足复分解反应的条件)。2.复分解反应(1)概念:由 互相交换成分,生成另外 的反应。(2)通式:(3)条件:生成物中有 、 或 生成。
盐(可溶)+金属1→金属2+新盐
盐1+盐2→新盐1+新盐2
【拓展思考4】 (1)盐的水溶液一定呈中性吗?答案:盐的水溶液不一定呈中性,有的盐溶液如Na2CO3溶液呈碱性,有的盐溶液如NH4Cl溶液呈酸性。(2)盐都是由金属离子和酸根离子构成的吗?
3.化学肥料(1)常用化肥
铵态氮肥不能和碱性物质混合施用。
(3)使用化肥对环境的影响化肥的不合理施用,会 、 、 。
【拓展思考5】 (1)单位面积内化肥施用越多越好吗?答案:不是。过多的施用化肥,可能造成庄稼营养过剩而死亡。(2)所有的化肥都可混合施用吗?答案:并不是所有的化肥都可混合施用,如当铵态氮肥和草木灰混合施用时,会发生反应放出氨气,不但不会增加肥效,反而会使肥效降低。
一、溶液pH的变化规律1.酸性溶液加水稀释pH变大,但只能接近7,不会大于7(酸性溶液不会稀释成碱性溶液),如图A所示。2.酸性溶液加碱pH变大,随着不断加碱,pH会大于7,如图B所示。3.碱性溶液加水稀释, pH变小,但只能接近7,不会小于7(碱性溶液不会稀释成酸性溶液),如图C所示。4.碱性溶液加酸pH变小,随着不断加酸,pH会小于7,如图D所示。
【例1】 (2019德州)向某稀盐酸中逐渐加入试剂X后溶液的pH变化如图。试剂X可能是下列物质中的( )A.H2OD.CaCO3
解析:向稀盐酸中加入水时,酸性减弱,pH升高,但是不能升高到7,更不能大于7,试剂X不能是水,A错误;向稀盐酸中加入硫酸时,溶液仍然显酸性,pH不可能等于或大于7,试剂X不能是硫酸,B错误;向稀盐酸中加入氢氧化钠时,稀盐酸和氢氧化钠反应生成氯化钠和水,恰好完全反应时pH等于7,氢氧化钠过量时,pH大于7,试剂X可以是氢氧化钠,C正确;向稀盐酸中加入碳酸钙时,稀盐酸和碳酸钙反应生成氯化钙、水和二氧化碳,pH升高,当稀盐酸完全反应时,pH等于7,但是不能大于7,试剂X不能是碳酸钙,D错误。答案:C
二、判断复分解反应发生的条件1.首先考虑反应物的溶解性,即“两溶酸不管”,两种参与复分解反应的化合物必须都能溶于水,当反应物中有酸时,可以不考虑另一反应物的可溶性。2.要考虑复分解反应发生的条件,生成物中如果有沉淀析出,或有气体放出,或有水生成,那么复分解反应就可以发生,否则不能发生。3.判断两种化合物能否发生复分解反应,反应物、生成物的溶解性都是很重要的因素。4.不参加复分解反应的盐:AgCl、BaSO4、KNO3、NaNO3。
【例2】下列物质间不能发生复分解反应的是( )A.碳酸钠溶液和氯化钙溶液B.氢氧化钠溶液和氯化钾溶液C.碳酸钾溶液和盐酸D.硫酸铜溶液和氯化钡溶液
解析:碳酸钠溶液和氯化钙溶液相互交换成分生成碳酸钙沉淀和氯化钠,能发生复分解反应,故A不符合题意;氢氧化钠溶液和氯化钾溶液相互交换成分没有沉淀、气体或水生成,不能发生复分解反应,故B符合题意;碳酸钾溶液和盐酸相互交换成分生成氯化钾、水和二氧化碳,能发生复分解反应,故C不符合题意;硫酸铜溶液和氯化钡溶液相互交换成分生成硫酸钡沉淀和氯化铜,能发生复分解反应,故D不符合题意。答案:B
1.(2019苏州)下列关于浓硫酸的说法正确的是( )A.易挥发B.有腐蚀性C.无吸水性D.密度比水小
解析:浓硫酸具有吸水性、腐蚀性、不挥发、密度比水大、溶解放热等性质。
2.(2019河南)下列溶液在空气中敞口放置后,溶液质量因发生化学反应而减小的是( )A.石灰水B.浓硫酸C.浓盐酸D.烧碱溶液
解析:石灰水可与空气中的二氧化碳反应,每74份质量的氢氧化钙和每44份质量的二氧化碳反应生成100份质量的碳酸钙,从溶液中析出的沉淀质量大于进入溶液的气体质量,故溶液质量减小,故A正确;浓硫酸具有吸水性,质量增加,不发生化学变化,故B错误;浓盐酸具有挥发性,质量减小,但不发生化学变化,故C错误;烧碱溶液易与二氧化碳反应生成碳酸钠而使溶液质量增加,故D错误。
3.(2019邵阳)下表是人体内一些体液的正常pH范围:
解析:pH小于7的溶液呈酸性,且pH越小,酸性越强,所以酸性最强的是胃液。
其中酸性最强的是( )A.血浆B.唾液C.胃液D.尿液
4.(2019云南)下列化肥属于氮肥的是( )A.CO(NH2)2B.Ca3(PO4)2C.KCl D.KH2PO4
解析:CO(NH2)2中含有氮元素,属于氮肥;Ca3(PO4)2中含有磷元素,属于磷肥;KCl中含有钾元素,属于钾肥;KH2PO4中含有钾元素和磷元素,属于复合肥。
5.(2019荆州)下列各组物质在水溶液中能大量共存且形成无色溶液的是( )A.NaCl BaCl2 Na2CO3B.KNO3 HCl CaCl2C.H2SO4 FeCl3 NaNO3D.NaOH HNO3 NH4NO3
解析:BaCl2、Na2CO3在溶液中能相互交换成分生成碳酸钡沉淀,不能大量共存,故A错误;三者之间不反应,能大量共存,且不存在有色离子,故B正确;三者之间不反应,能大量共存;但FeCl3的水溶液呈黄色,故C错误;NaOH与HNO3、NH4NO3在溶液中能相互交换成分,分别生成硝酸钠和水,硝酸钠、水和氨气,不能大量共存,故D错误。
6.(2019长沙)小军同学来到他家厨房,他不可能找到的调味品是( )A.食盐(氯化钠)B.醋(醋酸)C.酒(乙醇)D.胆矾(硫酸铜晶体)
解析:厨房中有调味品食盐;厨房中有调味品食醋;厨房中有调味品料酒;厨房中没有胆矾,胆矾不是调味品。
7.下列几种气体可用如图所示装置干燥、收集的正确组合是( )①H2 ②O2 ③CO2 ④SO2 ⑤CH4 ⑥NH3A.①②③B.②③⑤C.③④⑥D.①⑤⑥
解析:H2、O2、CH4、NH3均不与NaOH或CaO反应,故可用碱石灰干燥,但该收集装置只能用于收集密度比空气小的气体,故应排除O2,故选D。
8.将一定量的氢氧化钠溶液与稀盐酸混合,二者恰好完全反应的微观示意图如下。由此分析下列说法正确的是( )A.反应前后阴、阳离子的总数目不变B.反应前后溶剂质量不变C.反应后溶液呈中性D.反应前后元素种类发生了变化
解析:根据微观示意图可知,反应前后阴、阳离子的总数目发生改变;因为反应后生成水,故反应后溶剂的质量增加;反应后为氯化钠溶液,故溶液呈中性;根据质量守恒定律可知,元素的种类没有发生变化。
解析:铜离子和镁离子均不能与氢氧根离子共存,故A错误;氢离子和碳酸根离子不能共存,钡离子与硫酸根离子和碳酸根离子均不能共存,故B错误;C中四种离子相互之间不能反应,可以共存,故C正确;氢离子和氢氧根离子不能共存,钙离子和氢氧根离子不能共存,故D错误。
9.(2019宿迁)下列各组离子在水溶液中,能大量共存的是( )
解析:分别加少量水溶解时,溶液温度无明显变化的是氯化钠,溶液温度降低的是硝酸铵,A正确;分别通入二氧化碳时,无明显现象的是氢氧化钠溶液,溶液变浑浊的是澄清石灰水,B正确;加入足量的锌粉,锌和硫酸铜反应生成硫酸锌和铜,充分反应后过滤除去铜和过量的锌粉得到硫酸锌溶液,C正确;加入适量的稀盐酸时,氢氧化钾和稀盐酸反应生成氯化钾和水,除去氢氧化钾的同时引入新的杂质氯化钾,D错误。
10.下列实验操作不能达到实验目的的是( )
11.(2019广东)学习了单质、氧化物、酸、碱、盐的性质后,发现有很多不同类别的物质在发生反应时都有盐生成(其他物质省略),如图所示。请回答:
(1)若盐是硫酸钾,则①中发生反应的化学方程式为 。(2)若盐是氯化亚铁,则在已显示的变化中可以通过置换反应来实现的有 (填序号)。
(2)若盐是氯化亚铁,在已显示的变化中可以通过置换反应来实现的有:铁和盐酸反应会生成氯化亚铁,铁和氯化铜反应会生成氯化亚铁,故选④⑥。
(3)若盐是硝酸铜,由⑦来实现的化学方程式为 。(4)图中⑤处应补充的文字是 (写一种,不能与图中已有信息重复)。
酸+金属氧化物(合理即可)
(4)结合题中的转化关系,图中⑤处应补充的文字是:酸+金属氧化物或碱+非金属氧化物。
12.某校化学兴趣小组在学完碱的化学性质后,做了澄清石灰水和稀盐酸反应的实验,并将废液倒入一洁净的废液缸中,进行了如下探究:探究Ⅰ:甲同学在做该实验时没有观察到明显现象,于是对澄清石灰水和稀盐酸能否发生反应表示怀疑,乙同学认为,甲同学实验前应先向澄清石灰水中滴几滴酚酞溶液,再滴加适量的稀盐酸,当观察到 时,就可以说明两种物质能发生反应。
解析:探究Ⅰ:甲同学在做实验前应先向澄清石灰水中滴几滴酚酞溶液,再滴加适量的稀盐酸,当观察到溶液的红色逐渐褪去时,就可以说明两种物质能发生反应。
探究Ⅱ:废液中溶质的成分是什么?【作出猜想】猜想一:CaCl2猜想二:CaCl2、HCl猜想三:CaCl2、HCl、Ca(OH)2 你的猜想: 丙同学认为猜想三是错误的,理由是 (用化学方程式解释)。
CaCl2、Ca(OH)2
解析:【实验设计】戊同学取几粒锌粒于一支试管中,向其中加入少量废液,锌粒逐渐溶解,有气泡产生,猜想二正确。
【评价与反思】请判断以上设计的两个方案中, 同学的方案合理,请分析另一个方案不合理的理由: 。【表达与交流】若实验证明猜想二是正确的,你认为该废液未经处理直接倒入下水道,可能造成的危害是 (填一点)。
解析:【评价与反思】设计的两个方案中,戊同学的方案合理,丁同学的方案不合理,原因是猜想中都有氯化钙,加碳酸钠溶液都会产生白色沉淀。【表达与交流】若猜想二正确,则该废液呈酸性,直接倒入下水道可能造成的危害是腐蚀下水道或污染水质,合理即可。
猜想中都有氯化钙,加碳酸钠溶液都会产生白色沉淀
腐蚀下水道(或污染水质)(合理即可)
①运用酸碱指示剂鉴别溶液酸碱性。②以生活中的一些物质为背景,考查溶液酸碱性的强弱与pH的关系;以及溶液pH的测定方法及注意事项。③结合图像考查溶液稀释、浓缩、混合过程中pH的变化。
【例1】 (2019广东)下列水果中酸度最强的是( )A.菠萝pH=4.1B.木瓜pH=5.5C.草莓pH=3.2D.柠檬pH=2.3
点拨:当溶液的pHc
解析:由图可以看出是向盐酸中加入氢氧化钠溶液,在a、b、c三种曲线所示的实验中,恰好完全反应,即pH=7时,需要氢氧化钠溶液体积相等,因此所用盐酸浓度越大,需要加入的氢氧化钠溶液浓度也越大,V时氢氧化钠溶液过量,所得溶液的pH越大,A正确;题图是向盐酸中加入氢氧化钠溶液,在a曲线所示的实验中,若用酚酞作指示剂,酚酞溶液由无色变为红色,B不正确;在a、b、c三种曲线所示的实验中,由于反应物浓度不同,反应速率不相同,C不正确;在a、b、c三种曲线所示的实验中,溶液碱性由强到弱的顺序是a>b>c,D不正确。
2.(2019新疆)中和反应在日常生活中应用广泛,下列是稀盐酸和氢氧化钠溶液反应的微观示意图。回答以下问题:
解析:(1)题图中反应前后没有发生变化的微粒是钠离子、氯离子,反应的实质是氢离子和氢氧根离子结合生成水分子。(2)根据酸性溶液能使石蕊变红的性质,取少量反应后的溶液于试管中,滴加石蕊溶液,石蕊溶液变红,说明溶液显酸性。
(1)分析图中反应前后没有发生变化的微粒是 、 ;反应的实质是 。 (2)如果规定上述反应后溶液的pH
相关课件
这是一份化学九年级下册8.5 化学肥料图片课件ppt,共26页。PPT课件主要包含了新课导入,常用化肥,尿素CONH22,氮肥壮叶,灰色能溶于水,灰色部分溶于水,磷肥壮果,氯化钾KCl,钾肥壮茎,无色晶体易溶于水等内容,欢迎下载使用。
这是一份化学九年级下册8.3 酸和碱的反应集体备课课件ppt,共23页。PPT课件主要包含了新课导入,溶液的导电性,酸与碱的中和反应,步骤与现象,解释与结论,不变色,非金属,中和反应的应用,改良酸性或碱性的土壤,废水处理等内容,欢迎下载使用。
这是一份科粤版中考化学复习第八章常见的酸、碱、盐第18课时常见的盐化学肥料课件,共40页。PPT课件主要包含了答案是C,Cu2+,白色固体,白色沉淀生成,加入适量,K2CO3,无明显现象,产生白色沉淀等内容,欢迎下载使用。








