





2021年春鲁教版化学中考第一轮复习课件 第7单元 溶液的酸碱性 酸碱中和反应
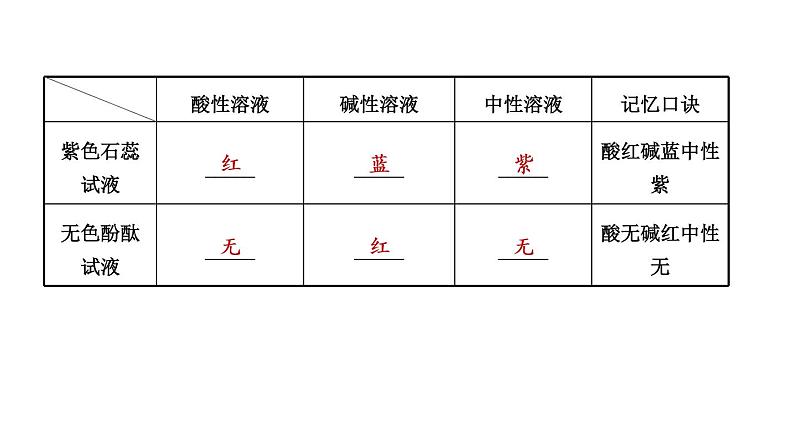
展开(2)石蕊试纸:为了方便实验,化学上分别用含有石蕊的酸溶液或碱溶液制成石蕊试纸。蓝色石蕊试纸遇酸性溶液变成_____色,红色石蕊试纸遇碱性溶液变成_____色。
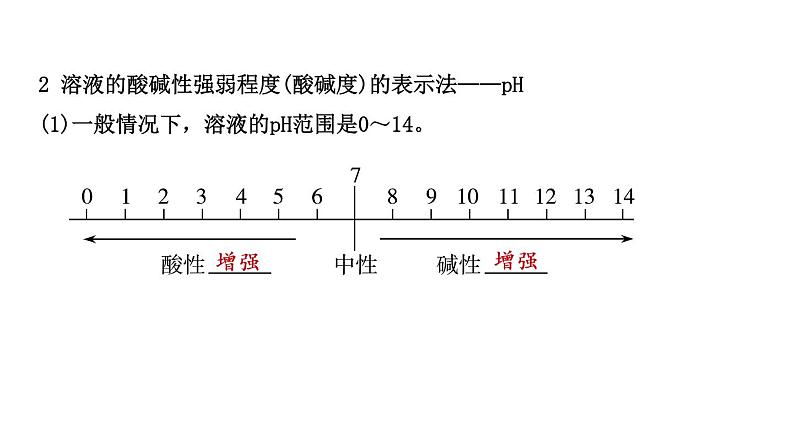
2 溶液的酸碱性强弱程度(酸碱度)的表示法——pH(1)一般情况下,溶液的pH范围是0~14。
(2)溶液pH的测定方法通常用pH试纸测定溶液的pH,方法:_________________________________________________________________________________________________________________________________________________。在科学研究中,也常使用一种叫作pH计的电子仪器测定溶液的pH。
在洁净干燥的玻璃片或白瓷板上放一
片pH试纸,用洁净干燥的玻璃棒蘸取待测液溶液,滴到试纸上,立即将试
纸显示的颜色与pH标准比色卡对照,读出对应的pH
3 物质的酸碱性对生命活动的意义(1)人的体液的pH必须维持在一定范围内,如果超出正常范围,就会导致生理机能失调或产生疾病,甚至死亡。(2)胃液中的胃酸主要成分是_______,能帮助消化食物,如果胃酸分泌过多,则会导致胃酸过多症。(3)土壤的酸碱性强弱对植物的生长具有非常重要的意义。大多数的植物适宜在接近_______的土壤中生长,土壤的酸性太强(pH____4)或碱性太强(pH____8),作物都不能正常生长。
(4)pH<______的降雨称为酸雨,酸雨能酸化土壤、污染水体、腐蚀建筑及文物古迹、加速金属制品的锈蚀,已成为全球性灾难。
【典例1】(2020·枣庄)预防新型冠状病毒肺炎,常用84消毒液对环境进行消杀。常温下测得某84消毒液显碱性,其pH可能为( )A.12 B.5 C.7 D.2
【典例2】(2019·临沂)人体内一些液体的正常pH范围如下:下列说法中不正确的是( )A.胆汁和胰液显碱性B.胃液比唾液酸性弱C.胰液比胆汁碱性强D.服用含氢氧化铝[Al(OH)3]的药物可以治疗胃酸过多症
【典例3】用pH试纸测定石灰水的pH,如图所示,则测得结果与实际值相比( )A.偏高 B.偏低C.相等 D.无法确定
【典例4】下列所示图像能正确反映对应的实验或事实的是( )
A.向pH=12的氢氧化钠溶液中不断加水稀释B.向pH=2的稀硫酸中滴加适量氯化钡溶液C.向稀盐酸中滴加过量的烧碱溶液D.向一定量的氢氧化钠溶液中滴加pH=3的稀盐酸
1 概念:_________作用生成_________的反应。2 实质:H++OH-====H2O。酸中的____ 和碱中的______结合生成_____的过程。
3 应用(1)用于医药卫生:服用碱性药物如氢氧化镁、氢氧化铝治疗胃酸过多。(2)改良土壤:如用氢氧化钙改良酸性土壤。(3)处理工业废水:如用氢氧化钙处理酸性废液。(4)调节溶液的酸碱性:如科学实验中,经常需要将溶液的pH控制在一定范围内。
4 注意事项(1)治疗胃酸过多不能用氢氧化钠和氢氧化钙,因为二者有强烈的腐蚀性。(2)改良酸性土壤,处理工厂的酸性废水,通常用熟石灰而不用氢氧化钠,是由于氢氧化钠腐蚀性太强且成本高。5 中和反应的探究(详见重点实验探究栏目)
【典例5】(2018·枣庄)人若长期食用“镉大米”(镉含量超标)会引起痛痛病。研究表明水稻对镉的吸收率与土壤的pH有紧密关系(如图所示),下列物质中可用于改良土壤结构,降低水稻对镉吸收率的是( )A.氯化钾B.烧碱C.熟石灰D.硫酸亚铁(水溶液显酸性)
核心素养:科学探究与创新意识——主要体现在判断反应是否发生的方法创新。
1 中和反应的原理及实质(以NaOH溶液和稀HCl反应为例)(1)反应原理:______________________(用化学方程式表示)。(2)中和反应的实质是酸溶液中的____和碱溶液中的_____结合生成____。(即:H++OH-====H2O)。
NaOH+HCl====NaCl+H2O
2 判断中和反应是否发生的方法
3 实验分析及指示剂的选择指示剂一般选用_______试液,向氢氧化钠等碱性溶液中滴入几滴_______试液,溶液变为_______,逐滴滴入稀盐酸或稀硫酸至恰好中和时溶液呈中性,变为_______,中和反应完成。指示剂如果选用紫色石蕊试液,该试液在碱性溶液中呈_______,在中性溶液中呈_______,蓝色和紫色之间没有明显的界线,反应现象不易观察,故不常用紫色石蕊试液作中和反应的指示剂。
4 中和反应后溶液溶质成分的判断及检验中和反应后溶液溶质成分的判断可以从_______________和_______________两方面分析。
5 酸入碱与碱入酸的溶液pH变化曲线及溶质成分(1)“酸入碱”如图2:A点:pH>7,此时溶液中的溶质为_______;A~B段:pH逐渐减小,仍大于7,此时溶液中的溶质为_____________;B点:pH=7(反应结束),此时溶液中的溶质为_______;B~C段:pH逐渐减小,pH<7,此时溶液中的溶质为____________。
(2)“碱入酸”如图3:A点:pH<7,此时溶液中的溶质为______;A~B段:pH逐渐增大,仍小于7,此时溶液中的溶质为____________;B点:pH=7(反应结束),此时溶液中的溶质为_______; B~C段:pH逐渐增大,pH>7,此时溶液中的溶质为_____________。
6 中和反应的热效应:(以酸入碱为例)(1)先测量加入烧杯中的碱溶液的温度。(2)边加酸溶液,边不断搅拌并及时测量、记录溶液的温度。中和反应温度变化的图像如图所示(以盐酸加入氢氧化钠溶液中为例),中和反应放热,当酸碱恰好完全反应时温度达到最高。a点溶液中的溶质为_____________;b点溶液中的溶质为_______;c点溶液中的溶质为_____________。
(1)图1实验中,能说明氢氧化钠溶液与稀硫酸发生了化学反应的实验现象是____________________________,发生反应的化学方程式为________ ____________________。有同学提出也可以使用石蕊试液代替酚酞试液进行图1的实验。你认为___________(填“酚酞试液”或“石蕊试液”)更适合用于验证稀硫酸与氢氧化钠溶液发生中和反应,你的理由是________________________________________________________________________。
烧杯中的溶液由红色变为无色
H2SO4====Na2SO4+2H2O
碱性溶液中呈蓝色,在中性溶液中呈紫色,蓝色和紫色没有明显的界线
(2)实验过程中的pH变化曲线如图2所示。恰好完全反应的点为____点,c点所示溶液中含有的溶质是______________________________。(3)在如图右边的容器中画出体现氢氧化钠溶液与稀硫酸恰好完全反应后生成物的微观图。
硫酸钠、硫酸(或Na2SO4、H2SO4)
(4)实验后小明对烧杯内的溶液中的稀硫酸是否过量进行如下探究。除以上方案外,下列______(填序号)单独使用,也能验证稀硫酸是否过量。A.铜片 B.pH试纸C.氧化铜 D.紫色石蕊试液
【实验拓展】室温下,某同学利用图丙装置研究将氢氧化钠溶液慢慢滴加到盛有稀硫酸的烧杯中,并用温度传感器测量反应过程中溶液温度随时间的变化曲线如图丁所示:
鲁教版中考化学复习第七单元常见的酸和碱第二节溶液的酸碱性和酸碱中和反应课件: 这是一份鲁教版中考化学复习第七单元常见的酸和碱第二节溶液的酸碱性和酸碱中和反应课件,共27页。PPT课件主要包含了NaHCO3,OH-,硫酸或H2SO4等内容,欢迎下载使用。
2021年春鲁教版化学中考第一轮复习课件 第10单元 化学与健康: 这是一份2021年春鲁教版化学中考第一轮复习课件 第10单元 化学与健康,共21页。PPT课件主要包含了蛋白质,维生素,化学元素与人体健康,人体中的化学元素,佝偻病,甲状腺肿大,远离有毒物质等内容,欢迎下载使用。
2021年春鲁教版化学中考第一轮复习课件 第9单元(2) 金属: 这是一份2021年春鲁教版化学中考第一轮复习课件 第9单元(2) 金属,共21页。PPT课件主要包含了3常见的合金,03%~2%,%~43%,混合物,熔点高,含碳量不同,导热性,金属的冶炼,常见的金属矿物,Fe2O3等内容,欢迎下载使用。












