
海南省海南中学2021届高三第五次月考 化学 (含答案)
展开海南中学2021届高三第五次月考
化学试题
可能用到的相对原子质量:H 1 O16 Fe 56 Cu 64 Mn 55 Zn 65
第I卷
一、选择题:本题共8小题,每小题2分,共16分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1. 薯片等容易挤碎的食品,一般用充气袋包装。充气袋中适宜填充的气体是
A. B. C. D.
2.以下列出的是基态原子2p轨道中电子排布的情况,违反洪特规则的是
A. B. C. D. ①②
3. 氧化铝用来制造耐火坩埚、耐火管和耐高温的实验仪器,是利用了氧化铝
A. 是白色固体 B. 不溶于水
C. 熔点很高 D. 是金属氧化物
时,的基元反应历程图如下。下列说法正确的是
A. 上图5种物质中c最不稳定 B. 反应过程中所有化学键都断开
C.反应一定没有能量变化 D. c分子间的碰撞全部是有效碰撞
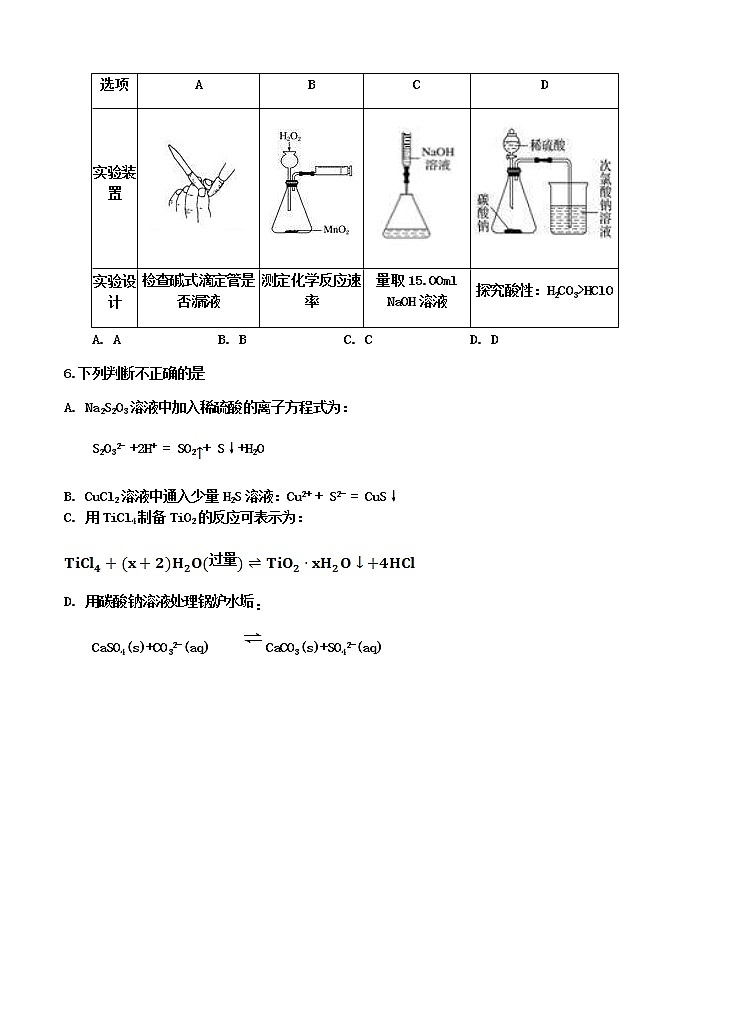
5.下列有关实验装置及实验方案的设计正确的是
选项 | A | B | C | D |
实验装置 | ||||
实验设计 | 检查碱式滴定管是否漏液 | 测定化学反应速率 | 量取15.00ml NaOH溶液 | 探究酸性:H2CO3>HClO |
A. A B. B C. C D. D
6.下列判断不正确的是
A. Na2S2O3溶液中加入稀硫酸的离子方程式为:
S2O32- +2H+ = SO2+ S↓+H2O
B. CuCl2溶液中通入少量H2S溶液:Cu2+ + S2- = CuS↓
C. 用TiCl4制备TiO2的反应可表示为:
过量
D. 用碳酸钠溶液处理锅炉水垢:
CaSO4(s)+CO32-(aq) CaCO3(s)+SO42-(aq)
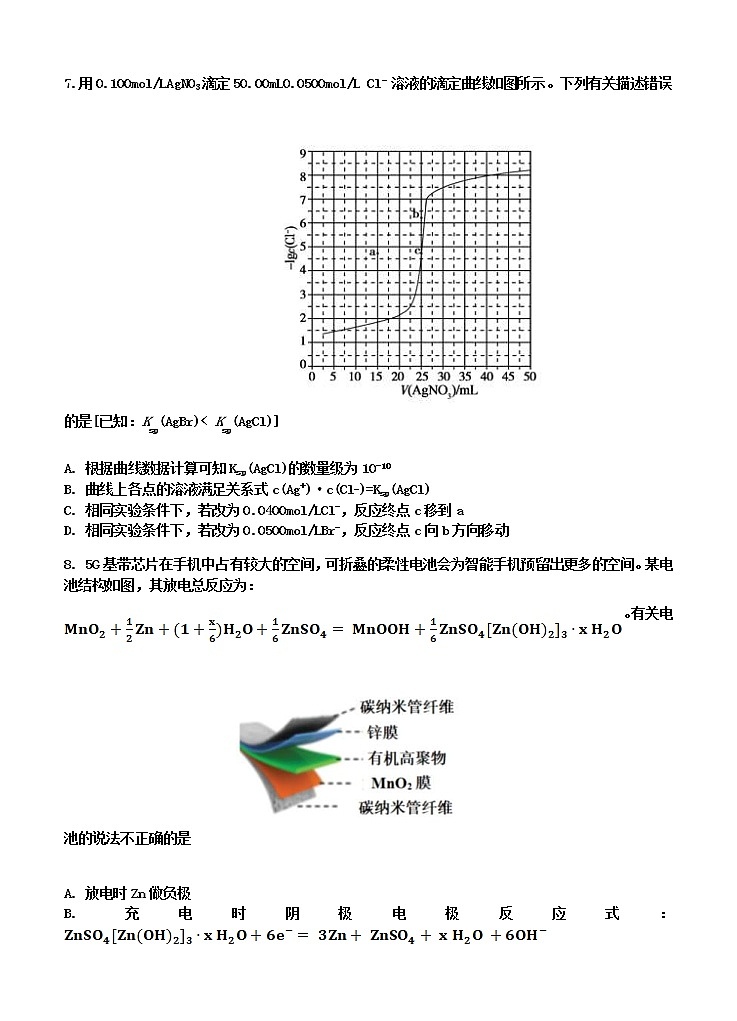
7.用0.100mol/LAgNO3滴定50.00mL0.0500mol/L Cl- 溶液的滴定曲线如图所示。下列有关描述错误的是[已知:Ksp(AgBr)< Ksp(AgCl)]
A. 根据曲线数据计算可知Ksp(AgCl)的数量级为10-10
B. 曲线上各点的溶液满足关系式c(Ag+)·c(Cl_)=Ksp(AgCl)
C. 相同实验条件下,若改为0.0400mol/LCl-,反应终点c移到a
D. 相同实验条件下,若改为0.0500mol/LBr-,反应终点c向b方向移动
8. 5G基带芯片在手机中占有较大的空间,可折叠的柔性电池会为智能手机预留出更多的空间。某电池结构如图,其放电总反应为:。有关电池的说法不正确的是
A. 放电时Zn做负极
B. 充电时阴极电极反应式:
C. 外电路中每通过1mol电子,膜质量就会增加2g
D. 碳纳米管具有导电性,可用作电极材料
二、选择题:本题共6小题,每小题4分,共24分。每小题有一个或两个选项是符合题目要求的。若正确答案只包括一个选项,多选得0分;若正确答案包括两个选项,只选一个且正确得2分,选两个且都正确得4分,但只要选错一个就得 0分。
9.某无色溶液中加入足量NaHCO3后仍能大量共存的离子组是
A. K+、AlO2-、Cl-、SO42- B. OH-、Ba2+、Cl-、K+
C. Ca2+、Cr2O72-、Cl-、NO3- D. K+、NH4+、NO3-、SO42-
10.对于反应,下列说法不正确的是
A.
C.升温不能提高反应速率 D.可利用此反应缓解空气污染
11. 甲、乙、丙三种物质有如下转化关系:,则甲不可能是
A. B. C. D.
12.根据25℃下列实验操作和现象所得出的结论不正确的是
选项 | 实验操作和现象 | 结论 |
A. | 向溶有SO2的BaCl2溶液中通入气体X,出现白色沉淀 | X具有强氧化性 |
B. | 将稀HClO4溶液滴入硅酸钠溶液中,充分振荡,有白色沉淀产生 | 非金属性:Cl>Si |
C. | 常温下,分别测定浓度均为0.1mol/L的NaF溶液和NaClO溶液的pH,后者的pH大 | 酸性:HF>HClO |
D. | 向3mL 0.1mol/LAgNO3溶液中先加入4-5滴0.1mol/LNaCl溶液,再滴加4-5滴0.1mol/LNaI溶液,先出现白色沉淀,后出现黄色沉淀 | 25℃ |
A. A B. B C. C D. D
13.推销商在推销其产品时,进行“电解水法”实验,将纯净水与自来水进行对比。当两电极分别插入纯净水和自来水中通电数分钟后,纯净水颜色无变化或略显黄色,而自来水却冒出气泡并生成灰绿色或红棕色的沉淀。根据上述现象,下列选项说法正确的是
A. 通电时,铝片做阳极,铁片做阴极
B. 生成的气泡、红棕色或灰绿色的沉淀都是电解的直接或间接产物
C. 通过对比,确实能说明自来水中含有大量对人体有毒有害的物质
D. 铁片的电极反应:
14. 室温条件下,下列有关电解质溶液的描述正确的是
A. 向溶液中通入至溶液为中性,则
B. pH相同的氨水和Ba溶液中:2c
C. 1L0.1mol/L的KOH的溶液充分吸收0.1molSO2后所得溶液中:
D. 向Mg浊液中加入少量粉末减小
第II卷(60分)
15.(10分)已知A、D、Y、Z都是元素周期表中前36号的元素,它们的原子序数依次增大。A原子最外层电子数是内层电子数的3倍,主族元素D最高正价数等于A的最低负价数,且D、Y、Z在同一周期,Y原子基态时未成对电子数在同周期元素中最多。Z的单质为紫红色固体,常用作导线。
(1)基态Y原子的价电子排布式为__________________,Y在________区。
(2)A与D形成化合物的电子式为_______。
(3)D的最高价氧化物对应的水化物的碱性___________Mg(OH)2(填:“>”或“<”)。
(4) 元素Z第二电离能比第一电离能大很多的主要原因是____________。
16.(14分)(1)常温下,PH=11的Na2S溶液中c(OH-)水=___________________________________,溶液呈碱性的原因是_____________________________(写出离子方程式),溶液中离子浓度大小顺序为_____________________。FeS溶于稀硫酸,而CuS不溶于稀硫酸,则 (填“”或“”。
(2)常温下,将pH=3的盐酸a L分别与下列三种溶液混合,所得溶液均呈中性。
①浓度为1.0×10-3mol·L-1的氨水bL;②c(OH-)=1×10-3mol·L-1的氨水cL;③c(OH-)=1×10-3mol·L-1的氢氧化钡溶液d L,则a、b、c、d之间的大小关系是______。
(3)某温度时,测得0.01mol·L-1NaOH溶液的pH=10。在此温度下,将pH=2的H2SO4溶液Va L与pH=12的NaOH溶液VbL混合,若所得混合液pH=11,则Va:Vb=_______(忽略溶液混合时体积的变化)。
(4)已知25℃时,Ksp[Fe(OH)3]=2.79×10-39,该温度下反应Fe(OH)3+3H+Fe3++3H2O的平衡常数K=______。
17.(12分)高氯酸铵(NH4ClO4)可用作火箭推进剂等。制备NH4ClO4的工艺流程如下:
(1)电解NaClO3溶液时,阳极的电极反应式为________________。
(2)“除杂”有两种方案。
①方案1:加入盐酸和H2O2溶液,NaClO3把H2O2氧化,本身转化为ClO2气体,反应的化学方程式为_____________________________。
方案2:加入氨水和FeCl2·4H2O, NaClO3转化为Cl-,反应的离子方程式为_______________________,如果FeCl2·4H2O过量会出现黑色磁性沉淀。
②本流程得出相同条件下氧化性:ClO3-________ClO4-(填“>”或“<”)。
③两种方案相比,方案1的优点是_____________________(答一条即可)。
( 3)该流程中可循环利用的物质是________________(填化学式)。
18.(12分)某同学在实验室进行铁盐与亚铁盐相互转化的实验:
实验Ⅰ:将Fe3+转化为Fe2+
(1)Fe3+与Cu粉发生反应的离子方程式为____________.
第
(页2)探究白色沉淀产生的原因,请填写实验方案:
实验方案 | 现象 | 结论 |
步骤1:取4ml0.1 mol/LCuSO4溶液,向其中滴加3滴0.1mol/LKSCN溶液 | 产生白色沉淀 | CuSO4与KSCN反应产生了白色沉淀 |
步骤2:取 ____________________ ____________________________ | 无明显现象 |
查阅资料:
ⅰ.SCN- 的化学性质与I-相似 ⅱ.2Cu2+ + 4I- = 2CuI↓+I2
Cu2+与SCN- 反应的离子方程式为_____________________________________。
实验Ⅱ:将Fe2+转化为Fe3+
实验方案 | 现象 |
向3mL0.1mol/LFeSO4溶液中加入1mL8mol/L稀硝酸 | 溶液变为棕色,放置一段时间后,棕色消失,溶液变为黄色 |
探究上述现象出现的原因,查阅资料:Fe2++NO ⇌ Fe(NO)2+(棕色)
(3)用离子方程式解释NO产生的原因________________________________。
(4)从化学反应速率与限度的角度对体系中存在的反应进行分析:
反应Ⅰ:Fe2+与HNO3反应 反应Ⅱ:Fe2+与NO反应
①依据实验现象,反应Ⅰ的速率比反应Ⅱ______(填“大”或“小”).
②已知反应Ⅰ是一个不可逆反应,请解释溶液由棕色变为黄色的原因_______
_________________________________________________________________。
19.(12分) 工业上用CO2氧化C2H6制C2H4是化工工业的一个新课题,相关主要化学反应有:
Ⅰ.C2H6(g)+CO2(g)⇌C2H4(g)+H2O(g)+CO(g)△H1
Ⅱ.C2H6(g)+2CO2(g)⇌4CO(g)+3H2(g)△H2=+430kJ•mol-1
则
(1)C2H6(g)+2CO(g)+3H2(g)⇌2C2H4(g)+2H2O(g)△H=______kJ•mol-1
(2)反应Ⅱ___________反应Ⅰ(填“有利于”或“不利于”)中乙烯生成;一定温度和压强下,为了提高反应速率和乙烯的选择性(乙烯的选择性=),应当_________________。
(3)容器体积为1.0L,控制C2H6和CO2初始投料量为2mol和3mol,乙烷的平衡转化率、乙烯的选择性与温度、压强的关系如图1所示。则X代表______(填“温度”或“压强”);L1和L2哪个大?并说出理由:______________________
___________________________________________________________________;M点反应Ⅰ的平衡常数为______________(结果保留2位有效数字)。
[标注△的是乙烯选择性曲线,另外两条是乙烷转化率曲线。]
海南中学2021届高三第五次月考
化学试题参考答案
题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 |
答案 | A | B | C | A | C | B | C | C | D | BC | B | AD | B | AC |
15.(10分);d;
(2)
(3)>
(4) Cu+的价层电子排布为3d10,全充满稳定结构失去1个电子比较难。
16. (14分)(1)1x10-3mol/L S2-+H2O HS- +OH-
c(Na+) >c(SO32-)>c(OH- )>c(HSO3- ) >c(H+ ) >
;
(3)90:11;
17. (12分) (1)
;;
③操作步骤简单或过量的H2O2易除去等合理答案
(3)NaCl
18. (12分) ;
(2)4mL0.2mol/LFeSO4溶液,向其中滴加3滴0.1mol/LKSCN溶液;;
;
小; Fe2+被HNO3氧化,导致Fe2+浓度降低,使平衡逆向移动,最终Fe(NO)2+完全转化为Fe3+,溶液由棕色变为黄色
19.(12分)(1)-76 (2)不利于 选择合适的催化剂
(3)温度 L代表压强,Ⅰ、Ⅱ的正反应均为体积增大的反应,增大压强,Ⅰ、Ⅱ反应均逆向进行,乙烷的转化率减小,故L2>L1
海南省华侨中学观澜湖学校2020届上学期高三第一次月考试题化学科含答案: 这是一份海南省华侨中学观澜湖学校2020届上学期高三第一次月考试题化学科含答案,共4页。试卷主要包含了本试卷分第Ⅰ卷两部分,用与 反应可制取纳米铁等内容,欢迎下载使用。
2024海南省海南中学高三上学期第三次月考试题化学含解析: 这是一份2024海南省海南中学高三上学期第三次月考试题化学含解析,共29页。试卷主要包含了5 Ti, 下列说法不正确的是, 下列化学用语表示正确的是, 下列方法可行的是, 肼是一种高能燃料等内容,欢迎下载使用。
海南省2023届高三学业水平诊断(三)化学试卷(含答案): 这是一份海南省2023届高三学业水平诊断(三)化学试卷(含答案),共13页。












