



人教版 (新课标)选修3 物质结构与性质第一章 原子结构与性质第二节 原子结构与元素的性质多媒体教学ppt课件
展开
这是一份人教版 (新课标)选修3 物质结构与性质第一章 原子结构与性质第二节 原子结构与元素的性质多媒体教学ppt课件,共39页。PPT课件主要包含了思考与探究,课堂练习,②以非金属元素为主,①均为金属元素,元素周期表的五个分区,科学探究六个问题,纵列问题2,族问题4,问题6,属P区等内容,欢迎下载使用。
【教学目标】认识原子结构与元素周期系的关系,了解周期系的应用价值。
江西省鹰潭市第一中学 桂耀荣
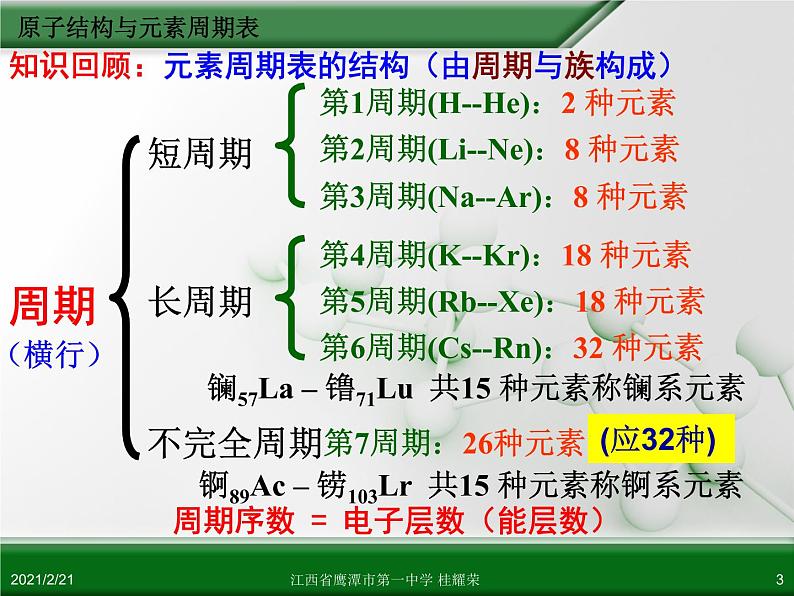
第1周期(H--He):2 种元素
第2周期(Li--Ne):8 种元素
第3周期(Na--Ar):8 种元素
第4周期(K--Kr):18 种元素
第5周期(Rb--Xe):18 种元素
第6周期(Cs--Rn):32 种元素
镧57La – 镥71Lu 共15 种元素称镧系元素
锕89Ac – 铹103Lr 共15 种元素称锕系元素
周期序数 = 电子层数(能层数)
知识回顾:元素周期表的结构(由周期与族构成)
ⅠA, ⅡA, ⅢA, ⅣA,ⅤA, ⅥA, ⅦA
主族序数=最外层电子数=价电子数=最高正价数
ⅠB, ⅡB, ⅢB, ⅣB,ⅤB, ⅥB, ⅦB
三个纵行(第8、9、10),位于Ⅶ B 与ⅠB中间
元素周期表从左到右族顺序依次为:
ⅠA , ⅡA , ⅢB , ⅣB ,ⅤB , ⅥB , ⅦB,第VIII 族; ⅠB , ⅡB , ⅢA , ⅣA ,ⅤA , ⅥA , ⅦA,零族
___________________________
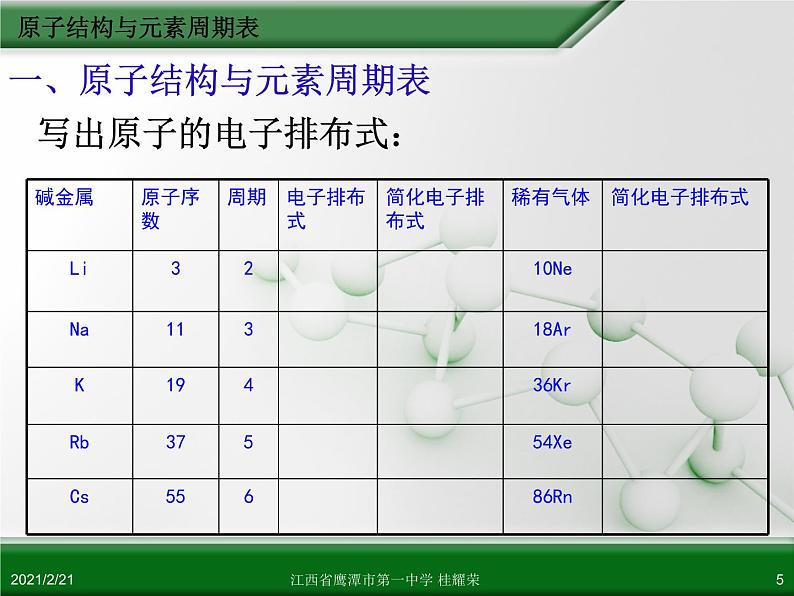
一、原子结构与元素周期表
写出原子的电子排布式:
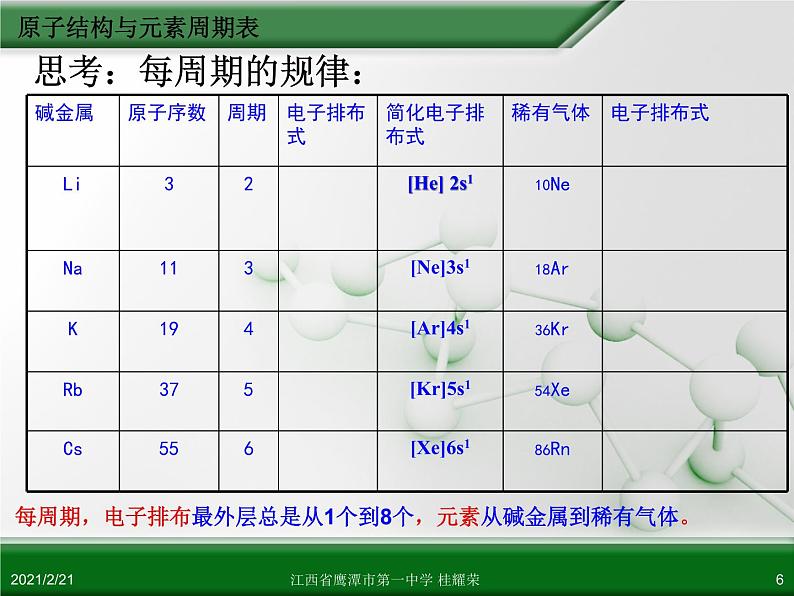
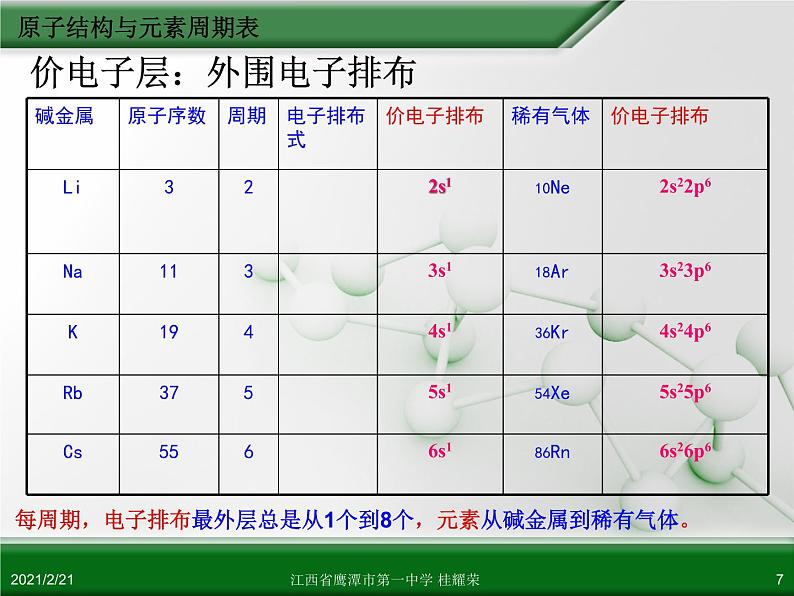
每周期,电子排布最外层总是从1个到8个,元素从碱金属到稀有气体。
价电子层:外围电子排布
随着原子序数的增加,元素原子的外围电子层排布呈现周期性的变化:每隔一定数目的元素,元素原子的外围电子层排布重复出现从ns1 到 ns2np6 的周期性变化。最外层电子数:从1到8 元素周期系的形成是由于元素的原子核外电子的排布发生周期性的重复。
(一)元素周期系的形成(1)周期系的形成随着元素原子的核电荷数的递增,每到出现__________,就开始建立一个新的电子层,随后最外层上的电子逐渐增多,最后达到8个电子,出现_____________;这样形成一个_______,循环往复形成周期系。
(2)原因:___________________的周期性重复。
(二)原子的电子排布与周期的划分
(1)观察周期表,我们会发现,每一周期的第一种元素(除第一周期外)是 ________, 最外层电子排布为______,每一周期的最后一种元素都是__________, 这些元素的最外层电子排布除He为1s2 外,其余都是__________.
(2)观察周期表发现周期表中周期序数等于该周期中元素的______.
结论:随着核电荷数的增加,核外电子的排布发生周期性的变化。
你能否根据原子结构与各周期中元素种数的关系分析元素周期系周期发展规律?
归纳: ( 3)、随着核电荷数的递增,电子在能级里的填充顺序遵循构造原理,元素周期系的周期不是单调的,每一周期里元素的数目不总是一样多,而是随着周期序号的递增渐渐增多。因而,我们可以把元素周期系的周期发展形象的比喻成螺壳上的螺旋。
元素周期系周期发展像螺壳上的螺旋
1、写出每个周期开头第一个元素的最外层电子的排布式?
ns1 (n表示电子层数)
第一周期:s2 其它周期:ns2np6 (n为电子层数)
2、写出每个周期最后一个元素的最外层电子的排布式?
科 学 探 究:P14
3、同族主族元素的价电子层有何规律?
4、同族过渡元素的价电子层有何规律?
价电子层上的电子总数相等
5、零族元素的价电子层有何规律?
(三)原子的电子排布与族的划分
在周期中有18个纵列,除零族元素中He(1s2)与其它稀有气体ns2np6不同外,一般说来,其它每个族序数和价电子数是一般相等的。主族元素:主族序数=原子的最外层电子数 =价电子数副族元素:副族序数(大多数) =(n-1)d+ns的电子数 =价电子数
1、已知某元素的原子序数是25,写出该元素原子的价电子层结构式,并指出该元素所属的周期和族。
其排布式为[Ar]3d54s2,
由于最高能级组数为4,其中有7个价电子,故该元素是第四周期ⅦB族。
按照电子排布,可把周期表的元素划分为5个区:s区、p区、d区、ds区、f区。划分区的依据是什么? s区、d区、p区分别有几个纵列?
区的名称来自按照构造原理最后填充的能级的符号
(四)元素周期表的分区
价电子数=主族序数=最外层电子数
含ⅠA与ⅡA共两族两列;价电子层为ns1或2(n≥1)
①价电子总数=主族序数(零族除外)
含ⅢA至ⅦA及零族共六族六列;价电子层为ns2 np1-6(n≥2) ,
②价电子总数=副族序数;若价电子总数为8、9、10,则为Ⅷ族。
含ⅢB至ⅦB和Ⅷ族共六族八列 (镧系和锕系属f区);价电子层为(n-1)d1-9ns1-2
说明: 核外电子的排布规律只是经验总结,并不是所有元素都一定符合。
含ⅢB至ⅦB和Ⅷ族共六族八列 (镧系和锕系属f区);价电子层为(n-1)d1-9ns1-2
4、ds区: 含ⅠB与ⅡB共两族两列; 价电子层为 (n-1)d10ns1或2
①价电子总数=所在的列序数
②均为金属元素;且d轨道电子全充满,一般不参与化学键的形成。
5、f区: 包括镧系与锕系;价电子层(n-2)f0-14(n-1)d0-2ns2
由于最外层电子数基本相同,(n-1)d电子数也基本相同,一般是(n-2)f的电子数不同,因此镧系元素化学性质相似;锕系元素化学性质也相似。
小结:(四)原子的电子构型和元素的分区
S 区元素:最外层构型是ns1和ns2。IA和 IIA族元 素。除H外,其余为活泼金属。
p区元素:最外层电子构型从ns2np1~ns2np6的元素。即IIIA~VIIA族、零族元素。除H外,所有非金属元素都在p区。
ds区元素:包括IB族和IIB族元素,最外层电子数皆为1~2个,均为金属元素 。
f区元素:包括镧系和锕系元素。最外层电子数基本相同,化学性质相似。
d区元素:包含第IIIB族到VIII族元素。最外层电子数皆为1~2个,均为金属元素,性质相似。
区全是金属元素,非金属元素主要集中 区。主族主要含 区,副族(过渡元素)主要含 区。
小结:分区与外围电子排布的关系
d、ds、f 区全是金属元素,非金属元素主要集中 P 区。主族主要含 s、p 区,副族(过渡元素)主要含 d、ds 区。
1. 横行:问题1七个周期;2,8,8,18,18,32种,不完全;最外层的排布式的通式为ns1 ns2np6;因为第一周期只有1s能级,电子排布式只能为1s2
18个纵列;相等【除零族元素He(1s2)外】
每个纵列的价电子构型和它们的族序数有什么联系?
主族:价电子层为ns或ns np型,价电子为最外层电子副族:价电子层一般出现d、f原子轨道等
3. 周期表的区域划分:问题3
S区:2列(IA、IIA) d区:8列(IIIB---VIII) P区:6列(IIIA---VIIA、0) ds区:2列(IB、IIB) f区:镧系、锕系
问:为什么s区、d区、ds区的元素都是金属(除H外)?
s区、d区、ds区的元素最外层电子数为1-2个电子,在反应中易失去,所以都是金属。
7主族:IA---VIIA 7副族:IIIB---IIB 第Ⅷ族 0族
副族元素包括d区、ds区元素,介于s区元素(主要是金属元素)和p区(主要是非金属)元素之间,处于由金属向非金属过渡的区域,因此,把副族元素又称为过渡元素
问题5:这是由元素的价电子层结构和元素周期表中元素性质的递变规律决定的。同周期元素从左到右非金属性增强同主族从上到下非金属性减弱,金属性增强结果使元素周期表右上角三角区内的元素主要呈现出非金属性。
由于元素的金属性和非金属性没有严格的界限,处于非金属三角区边缘的元素既能表现出一定的非金属性,又能表现出一定的金属性,因此这些元素常被称为半金属或准金属。
1、已知某元素在周期表中位于第五周期、ⅥA族位置上。试写出该元素基态原子的价电子排布式、电子排布式并分析该元素在哪区?
由于是ⅥA族, 4d必是全充满的,所以价电子排布为5s25p4,
电子排布式[Kr]4d105s25p4
2、下列元素是主族元素还是副族元素?第几周期?第几族?
(1)1s2 2s2 2p6 3s2 3p5(2)[Ar]3d10 4s1
3、由下列元素在周期表中的位置,给出其原子的价电子层构型
(3)第四周期第VIA族(4)第四周期第IVB族
P区,主族,第三周期,第VIIA族
ds区,副族,第四周期,第IB族
4、下列说法错误的是( )
A. S区元素的原子价电子层排布都是s结尾B. d区元素的原子价电子层排布都是ds结尾C. ds元素的原子价电子层排布都是ds结尾D. p区元素的原子价电子层排布都是sp结尾E. 主族元素的原子价电子层排布都含s,但都 不含dF. 过渡元素的原子价电子层排布都是ds结尾G. ds区元素的原子d轨道一定全满
相关课件
这是一份人教版 (新课标)选修3 物质结构与性质第一节 原子结构图文ppt课件,共30页。PPT课件主要包含了宇宙大爆炸,道尔顿原子模型,汤姆生原子模型,卢瑟福原子模型,α粒子散射实验,玻尔原子模型,能层与能级,1能层,核外电子分层排布,2能级等内容,欢迎下载使用。
这是一份高中化学人教版 (新课标)选修3 物质结构与性质第二章 分子结构与性质第三节 分子的性质课堂教学ppt课件,共22页。PPT课件主要包含了非极性键,Cl2Cl-Cl,极性键,共用电子对是否有偏向,判断方法,H-O-O-H,极性键非极性键,非极性分子,极性分子,F合0等内容,欢迎下载使用。
这是一份选修3 物质结构与性质第二节 分子的立体构型课文内容ppt课件,共24页。PPT课件主要包含了CuSO4•5H2O,SO42–,天蓝色,Na+,Cl-,Br-,配位键,1定义,一方提供孤电子对,一方提供空轨道等内容,欢迎下载使用。










