



选修3 物质结构与性质第二节 分子的立体构型课文内容ppt课件
展开江西省鹰潭市第一中学 桂耀荣
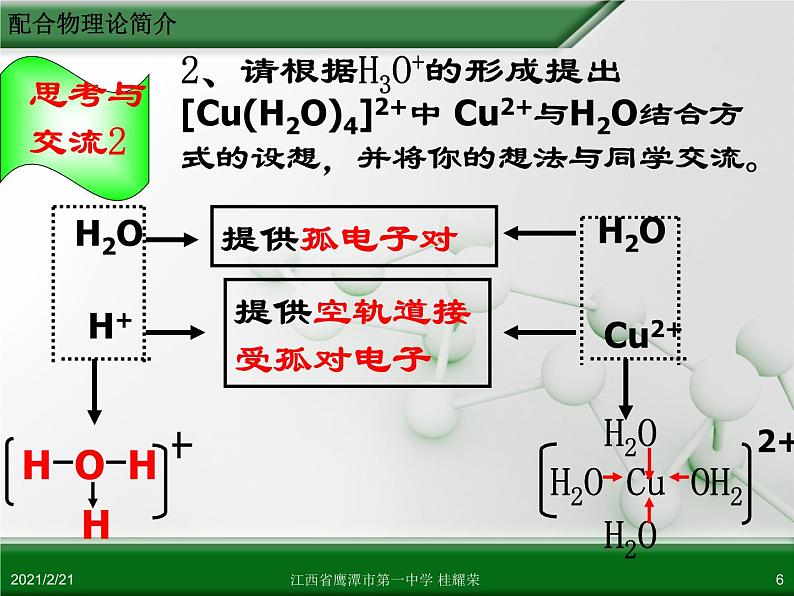
[Cu(H2O)4]2+
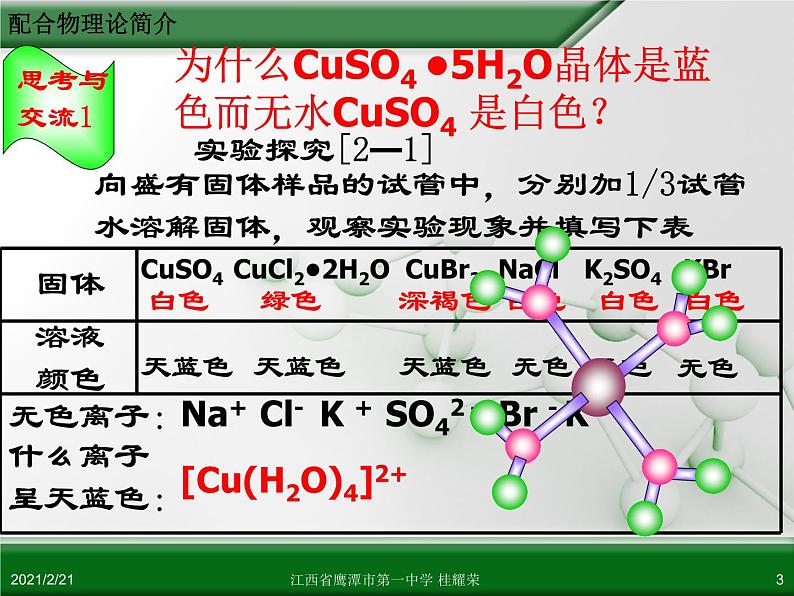
为什么CuSO4 •5H2O晶体是蓝色而无水CuSO4 是白色?
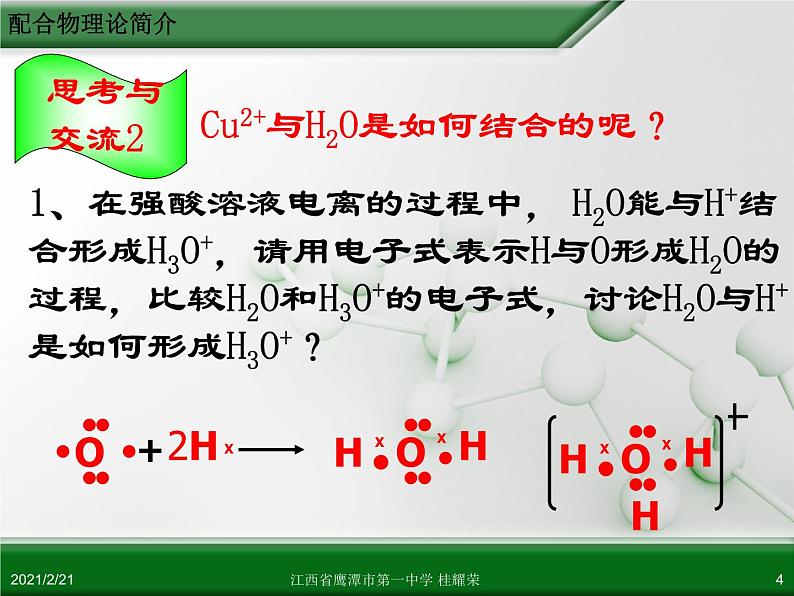
Cu2+与H2O是如何结合的呢?
1、在强酸溶液电离的过程中, H2O能与H+结合形成H3O+,请用电子式表示H与O形成H2O的过程,比较H2O和H3O+的电子式,讨论H2O与H+是如何形成H3O+?
(2)配位键的形成条件
(3)配位键的表示方法
提供孤电子对的原子与接受孤电子对的原子之间形成的共价键,
同其他相同原子形成的共价键键参数完全相同
即“电子对给予—接受键”
提供空轨道接受孤对电子
2、请根据H3O+的形成提出[Cu(H2O)4]2+中 Cu2+与H2O结合方式的设想,并将你的想法与同学交流。
(2) 配合物的组成
通常把接受孤电子对的金属离子(或原子)与某些提供孤电子对的分子或离子以配位键结合形成的化合物称为配位化合物,简称配合物
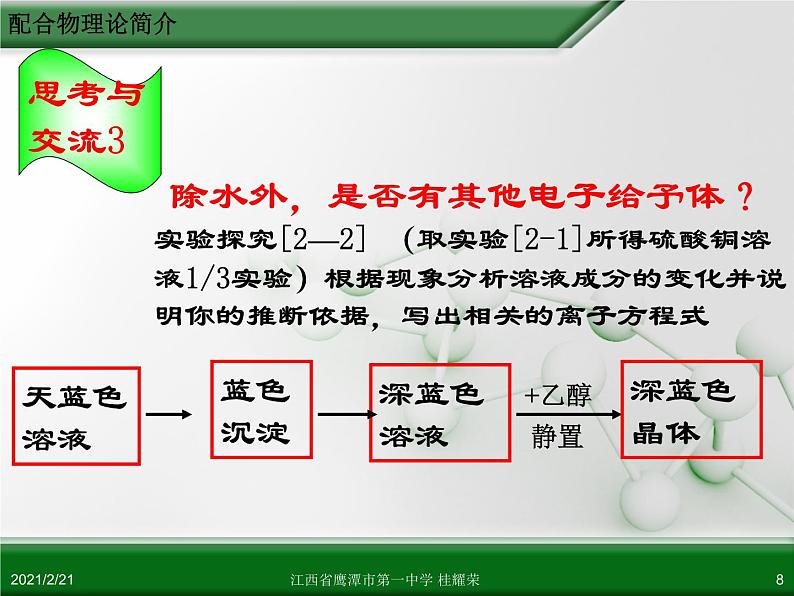
除水外,是否有其他电子给予体?
实验探究[2—2] (取实验[2-1]所得硫酸铜溶液1/3实验)根据现象分析溶液成分的变化并说明你的推断依据,写出相关的离子方程式
[Cu(NH3) 4 ] SO4•H2O
Fe3++3SCN- = Fe(SCN)3 血红色
Fe3+是如何检验的?
能形成配合物的离子不能大量共存
2、有Fe2+ Cu2+ Zn2+ Ag+ H2O NH3
一般中心离子所结合的配体个数
向实验[2—2]深蓝色溶液中滴加硫酸,观察实验现象,由此现象变化说明了什么
配合物具有一定的稳定性,配位键越强,配合物越稳定。过渡金属配合物远比主族金属易形成配合物
血红素(Fe2+ )结构示意图
第二代铂类抗癌药(碳铂)
固氮酶中Fe—M中心结构示意图
a 在生命体中的应用
d 在生产生活中的应用
电解氧化铝的助熔剂Na3[AlF6]
(1)配离子(从左向右,配位数→配体→合→中心原子或中心离子→化合物)(2)配合物→类似于酸、碱、盐
三氯一氨合铂(Ⅱ)酸钾
气态氯化铝(Al2Cl6)是具有配位键的化合物,分子中原子间成键关系如图所示,请将下列结构中你认为是配位键的斜线上加上箭头。
向下列配合物的水溶液中加入AgNO3溶液,不能生成AgCl沉淀的是( )
A. [C(NH3) 4Cl2] Cl
B. [C(NH3) 3Cl3]
C. [C(NH3) 6] Cl3
D. [C(NH3) 5Cl] Cl2
3、人体内血红蛋白是Fe2+卟林配合物, Fe2+与O2结合形成配合物,而CO与血红蛋白中的Fe2+也能生成配合物,根据生活常识,比较说明其配合物的稳定性。若发生CO使人中毒事故,首先该如何处理?还有哪种氧化物也可与血红蛋白中的Fe2+结合?
血红蛋白CO形成的配合物更稳定
发生CO中毒事故,应首先将病人移至通风处,必要时送医院抢救。
“电子对给予—接受键”
人教版 (新课标)选修3 物质结构与性质第一节 共价键课文配套课件ppt: 这是一份人教版 (新课标)选修3 物质结构与性质第一节 共价键课文配套课件ppt,共24页。PPT课件主要包含了共价键等内容,欢迎下载使用。
人教版 (新课标)选修3 物质结构与性质第三章 晶体结构与性质第四节 离子晶体说课ppt课件: 这是一份人教版 (新课标)选修3 物质结构与性质第三章 晶体结构与性质第四节 离子晶体说课ppt课件,共24页。PPT课件主要包含了离子晶体,乙为NaCl的晶胞,晶胞类型,2氯化铯型晶胞,CsCl晶胞,②F-的配位数4,①阳离子的配位数4,②阴离子的配位数4,科学探究,各种晶体类型的比较等内容,欢迎下载使用。
高中人教版 (新课标)第一节 共价键示范课ppt课件: 这是一份高中人教版 (新课标)第一节 共价键示范课ppt课件,共26页。PPT课件主要包含了表2-1,表2-2,思考与交流,H2O105°,NH3107°,CO2180°,物理性质,等电子原理,SO2,NO2-等内容,欢迎下载使用。













