




高中人教版 (新课标)第一节 共价键示范课ppt课件
展开【教学目标】1.能用键能、键长和键角说明简单分子的 某些性质,知道共价键的主要类型σ键和π键,能用键能、键长、键角等键参数判断简单分子的构型和稳定性。2.简单介绍等电子原理的概念及应用
江西省鹰潭市第一中学 桂耀荣
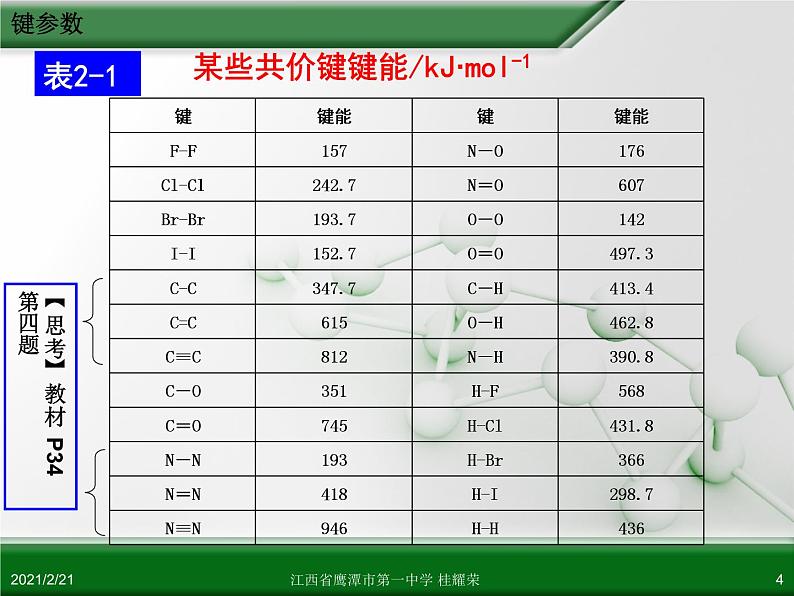
1.键能:气态基态原子形成1ml化学键释放的最低能量。
键能越大,化学键越稳定。
破坏1ml化学键形成气态基态原子所需的最低能量。
应用:计算化学反应的反应热(焓变)。
∆H = 反应物键能总和 - 生成物键能总和
二、键参数---键能,键长,键角
某些共价键键能/kJ·ml-1
(1) 规律:键能越大,化学键越牢固,由该键形成的分子越稳定。
(2) ∆H = 反应物键能总和 - 生成物键能总和
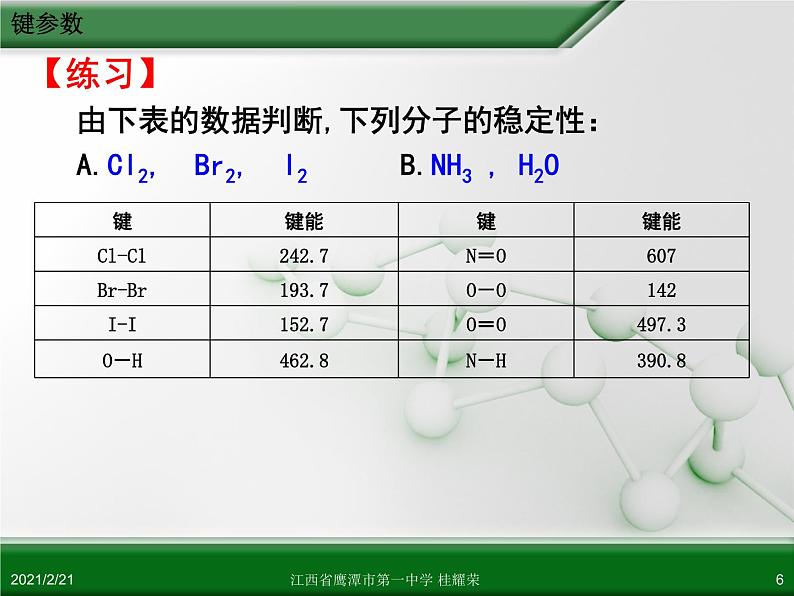
【练习】 由下表的数据判断,下列分子的稳定性: A.Cl2, Br2, I2 B.NH3 , H2O
【思考与交流1】P32
1.根据表2-1数据,计算1 mlH2分别跟1 mlCl2、1 ml Br2(蒸气)反应,分别生成2mlHCl和2mlHBr分子,哪个反应放出的能量多?结果又能说明什么?
H2 + Cl2 = 2HCl ΔH=436.0kJ·ml-1 + 242.7kJ·ml-1 —2×431.8kJ·ml-1 = —184.9kJ
H2 + Br2 = 2HBr ΔH=436.0kJ·ml-1 + 193.7kJ·ml-1 —2×366kJ·ml-1 = —102.7kJ
因为生成HCl放出的热量高于生成HBr放出的热量,所以生成的HCl较稳定
原理:∆H = 反应物键能总和 - 生成物键能总和
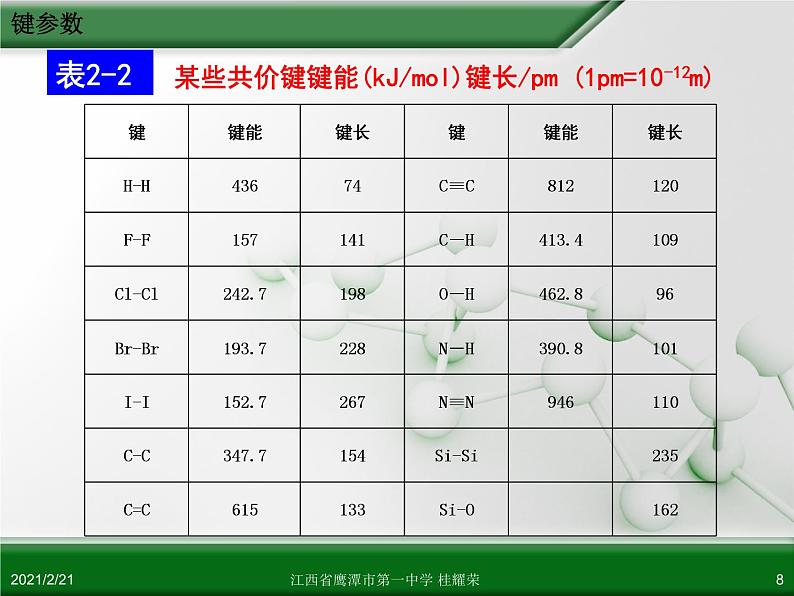
某些共价键键能(kJ/ml)键长/pm (1pm=10-12m)
2、键长:形成共价键的两个原子之间的核间距。键长是衡量共价稳定性的另一个参数。
【思考】对比表2-1和表2-2找出键长与键能及稳定性的关系。
规律:键长越短,一般键能越大,化学键越牢固,由该键形成的分子越稳定。
【练习】 由下表的数据判断,下列分子的稳定性 A.H2 , Cl2 B.HCl, HBr ,HI
⑴ N2、O2、F2跟H2的反应能力依次增强,从键能的角度应如何理解这一化学事实?⑵ 通过上例子,你认为键长、键能对分子的化学性质有什么影响?
一般地,形成的共价键的键能越大,键长越短,共价键越稳定,含有该键的分子越稳定,化学性质越稳定。
3、键角:两个共价键之间的夹角称为键角。
键角一定,表明共价键具有方向性。键角是描述分子立体结构的重要参数,分子的许多性质与键角有关。
键角决定分子的空间构型。
CH4 109°28’
【观察】P32页中表2-3的数据
从表中可以看出,CO分子与N2分子在许多性质上十分相似,这些相似性,可以归结为它们具有相等的价电子数,导致它们具有相似的化学结构。
表2-3 CO分子和N2分子的某些性质
等电子体: 原子总数相同、价电子总数相同的分子。
等电子体原理: 原子总数、价电子总数相同的分子具有相似的化学键特征,它们的许多性质是相近的。
等电子体的判断和利用(1)判断方法:原子总数相同,价电子总数相同的分子。(2)应用:等电子体的许多性质是相近的,空间构型是相同的。利用等电子体可以:①判断一些简单分子或离子的立体构型;②利用等电子体在性质上的相似性制造新材料;③利用等电子原理针对某物质找等电子体。
例举一些常见的等电子体
【练习】 原子数相同,最外层电子总数相同的分子,互称为等电子体。等电子体的结构相似,物理性质相似。
(1)根据上述原理,仅由第二周期元素组成的共价分子中,互为等电子体的是: 和 。(2)等电子原理又有发展,例如:由短周期元素组成的物质中,与NO2-互为等电子体的分子有 、 。
1、下列说法中,错误的是( )A.键长越长,化学键越牢固B.成键原子间原子轨道重叠越多,共价键越牢固C.对双原子分子来讲,键能越大,含有该键的分子越稳定D.原子间通过共用电子对所形成的化学键叫共价键
2、能够用键能解释的是( )A.氮气的化学性质比氧气稳定B.常温常压下,溴呈液体,碘为固体C.稀有气体一般很难发生化学反应D.硝酸易挥发,硫酸难挥发
二、键参数—键能、键长和键角
键能:气态基态原子形成1ml化学键释放的最低能量。
键长:形成共价键的两个原子之间的核间距。
键长越短,键能越大,化学键越稳定。
键角:两个共价键之间的夹角。
应用:计算化学反应的反应热。
∆H=反应物键能总和-生成物键能总和
等电子体: 原子总数、价电子总数相同的分子。
等电子体原理: 原子总数、价电子总数相同的分子具有相似的化学键特征,它们的许多性质相近。
人教版 (新课标)选修3 物质结构与性质第一节 原子结构图文ppt课件: 这是一份人教版 (新课标)选修3 物质结构与性质第一节 原子结构图文ppt课件,共30页。PPT课件主要包含了宇宙大爆炸,道尔顿原子模型,汤姆生原子模型,卢瑟福原子模型,α粒子散射实验,玻尔原子模型,能层与能级,1能层,核外电子分层排布,2能级等内容,欢迎下载使用。
人教版 (新课标)选修3 物质结构与性质第一节 共价键课文配套课件ppt: 这是一份人教版 (新课标)选修3 物质结构与性质第一节 共价键课文配套课件ppt,共24页。PPT课件主要包含了共价键等内容,欢迎下载使用。
高中化学第一节 晶体的常识课堂教学课件ppt: 这是一份高中化学第一节 晶体的常识课堂教学课件ppt,共52页。PPT课件主要包含了答案B,为什么呢,规律对立方晶胞等内容,欢迎下载使用。













