






人教版 (新课标)选修6 实验化学实验3-3 植物体中某些元素的检验一等奖ppt课件
展开1.应用已学知识和资料提供的检验离子的反应,检验常见物质中的某些元素。2.学习利用检验离子的反应探究身边物质组成元素的一般思路和方法。
一、实验原理许多阴、阳离子在溶液中能发生特征的化学反应,产生明显的实验现象,我们可以利用这些性质和现象,达到定性检验的目的。离子的检验反应都是在溶液中进行的,而生活中的物质并不都是溶液,因此要检验某物质所含有的成分元素,常需要对被检物进行预处理,使目标元素转移到溶液中。对植物等有机物,常用的预处理方法就是灼烧使之灰化,然后用酸溶解。
二、实验目的与部分流程1.实验目的:干柏树叶中含Ca、Fe、Al、P元素的定性检验。(1)实验部分流程:
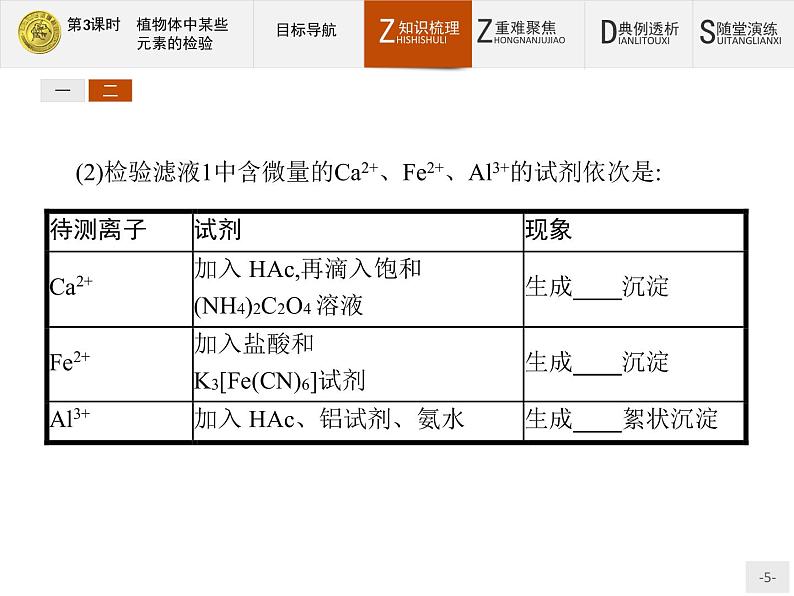
(2)检验滤液1中含微量的Ca2+、Fe2+、Al3+的试剂依次是:
2.拓展实验:检验海带中含碘元素。(1)实验部分流程:(2)干海带灼烧时酒精的作用是便于海带充分燃烧,试剂X是过氧化氢(或氯水),Y是淀粉,空方框中的现象是溶液呈蓝色,从而可以确认海带中含碘元素。
一、植物体中某些元素的检验实验注意事项植物中元素的检验,对植物的灰化、溶解等预处理非常重要。1.待测物的灰化要求待测物本身尽量干燥,研磨后应当反复加热,研磨若干次,以保证待测物完全灰化。2.检验常见的离子时,根据检出元素所需的状态或所测元素的检出状态的不同,采用不同的酸进行溶解。金属元素为通常条件下的价态,一般能溶解就行,通常采用稀盐酸或稀硫酸;非金属元素(如磷)要求检出形态为最高价态,所以使用浓硝酸进行处理。使用酸溶解灰分时,可以稍稍加热以促进物质的溶解,但浓硝酸加热时会分解,有二氧化氮生成,加热时注意通风,防止发生危险。过滤在较强的酸性环境下进行,使用耐酸的漏斗和滤纸进行操作。
3.灰化过程和溶解过程元素损失比较严重,稀释时如果不能很好地控制蒸馏水的用量,将使某些离子的浓度过低而无法检出。4.植物中含有多种微量元素,在制成的溶液里会存在大量的干扰离子,常需要先进行分离。但本实验中的三种离子的检验不存在干扰,如无特殊要求可以不进行分离和掩蔽。若遇需要进行分离的实验,一般采用沉淀法,利用离心机和离心试管分离。5.实验中对待测物进行溶解时,针对不同的待检元素采用了不同的酸进行溶解,一是为了有针对性地加大某元素的溶解度,二是为了不破坏某些元素离子的存在形式,三是为了在其后的检验中不引入干扰离子。6.蔬菜和水果中某元素的检测可以不用灰化,直接利用蔬菜汁或果汁,用活性炭脱色后,采用1∶1的硝酸酸化处理,对所得溶液进行检测。被检测离子选用易于检验的Fe、Al、Cu等元素。
二、离子检验时试剂的使用和操作1.Fe3+的检验:Fe3+与SCN-生成配位数不同的红色可溶性络合物,随着试剂浓度的增加,高配位数离子所占的比例增加,溶液颜色逐渐变深,反应的灵敏度也增加。碱能破坏红色络合物,生成Fe(OH)3沉淀,故反应必须在酸性溶液中进行。浓硝酸的氧化性可使SCN-受到破坏,浓盐酸中大量的Cl-与Fe3+形成2.Al3+的检验:Al3+与铝试剂在氨性溶液中生成亮红色絮状沉淀。3.Ca2+的检验:草酸钙法,即Ca2+与(NH4)2C2O4在pH>4时形成白色晶形沉淀,该沉淀溶于强酸,不溶于CH3COOH。
5.I-的检验:在酸性溶液中,加入氯水或硝酸,将I-氧化成I2,加入CCl4(或苯),振荡,有机试剂层显紫色。
三、物质鉴别的常用方法
知识点1 植物体中某些元素的检验【例题1】 茶是我国人民喜爱的饮品。某校化学兴趣小组的同学设计以下实验来定性检验茶叶中含有Ca、Al、Fe三种元素。【查阅部分资料】草酸铵[(NH4)2C2O4]属于弱电解质。草酸钙(CaC2O4)难溶于水。Ca2+、Al3+、Fe3+完全沉淀的pH分别为Ca(OH)2:pH≥13;Al(OH)3:pH≥5.5;Fe(OH)3:pH≥4.1。
试根据上述过程及信息填空:(1)步骤②加盐酸的作用是 。 (2)写出检验Ca2+的离子方程式: 。 (3)写出沉淀C所含主要物质的化学式: 。 (4)写出步骤⑧用A试剂生成红色溶液的离子方程式: 。 (5)步骤⑨的作用是 ,猜测步骤⑩的目的是 。
解析:用化学方法分离、检验植物样品中的某些元素时,通常将待检验的植物样品高温灼烧,使其中的有机物分解。其中的碳、氢、氧等元素转化为二氧化碳和水,呈气态逸散,待测的金属或非金属元素以氧化物或无机盐(称灰分)的形式残留下来。在残留的灰分中加入水或酸,使灰分溶解。过滤后,滤液可用于分离和鉴定某些元素。答案:(1)使Ca2+、Al3+、Fe3+浸出(或使Ca2+、Al3+、Fe3+溶解)(3)Fe(OH)3、Al(OH)3(4)Fe3++3SCN- Fe(SCN)3(写成其他正确的络合离子形式也可)(5)使Fe3+转化为Fe(OH)3沉淀 检验Al3+(或铝元素)的存在
点拨对于教材实验中给出的[资料]内检验Al3+的铝试剂、镁试剂等特殊试剂,不必强记。需要时通过查阅各种化学实验书籍或实验手册,查找常见离子的检验方法。
知识点2 设计检验方案【例题2】 三草酸合铁酸钾晶体K3[Fe(C2O4)3]·3H2O可用于摄影和蓝色印刷。某小组将无水三草酸合铁酸钾在一定条件下加热分解,对所得气体产物和固体产物进行实验和探究。请利用实验室常用仪器、用品和以下限选试剂完成验证和探究过程。限选试剂:浓硫酸、1.0 ml·L-1硝酸、1.0 ml·L-1盐酸、1.0 ml·L-1 NaOH溶液、质量分数为3%的过氧化氢溶液、0.1 ml·L-1 KI溶液、0.1 ml·L-1 CuSO4溶液、质量分数为20%的KSCN溶液、澄清石灰水、氧化铜、蒸馏水。(1)将气体产物依次通过澄清石灰水(A)、浓硫酸、灼热氧化铜(B)、澄清石灰水(C),观察到A、C中澄清石灰水都变浑浊,B中有红色固体生成,则气体产物是 。
(2)该小组同学查阅资料后推知,固体产物中,铁元素不可能以三价形式存在,而盐只有K2CO3。验证固体产物中钾元素存在的方法是 ,现象是 。 (3)固体产物中铁元素存在形式的探究。①提出合理假设。假设一: ;假设二: ;假设三: 。 ②设计实验方案证明你的假设。
③实验过程。根据②中方案进行实验。按下表的格式写出实验步骤、预期现象与结论。
解析:(1)A、C均有沉淀生成说明两处均有CO2,又因B处灼热的氧化铜(黑色)变为红色,则说明混合气体中CO2、CO均存在。(2)钾的检验只能通过焰色反应,但是要观察钾的焰色反应必须透过蓝色钴玻璃(滤去钠的黄光,避免干扰)。(3)①因铁元素不能以+3价形式存在,并且固体中只有K2CO3,故铁可能以FeO或单质形式存在,也可能二者都存在。Fe、FeO均不溶于水也不与水反应,可利用蒸馏水除去可溶性的碳酸钾,再利用铁能够置换铜,提供足量的CuSO4溶液去除过滤后的固体中可能存在的Fe,因FeO与非氧化性酸如盐酸或稀硫酸反应能转化为Fe2+,进而加入氯水或双氧水等氧化剂及KSCN溶液以确认是否有FeO。
答案:(1)CO和CO2(2)利用焰色反应 透过蓝色钴玻璃观察到紫色火焰(3)①全部为铁单质 全部为FeO 同时存在铁单质和FeO③
点拨研究性学习是新课标亮点之一,微型课题式试题是新高考命题热点。根据“猜想”设计实验方案,加入试剂过量,以确保物质完全反应;填写实验报告时,要写出较详细的实验步骤,理顺思路,准确描述。
1 2 3 4
2(双选)某同学拟用厨房用品进行如下化学实验,你认为他能实现的是( )A.验证鸡蛋壳中含有碳酸盐B.用白酒和食醋制取少量乙酸乙酯C.利用化学方法除去菜刀上的铁锈及水壶中的水垢D.证明加碘食盐中存在
3下面分别是4位同学设定的从茶叶中提取咖啡因的方案,请你对4位同学的设计进行分析评价,并指出其不足。
答案:(1)方案,为使茶叶中的物质能充分地浸取出来,加入的浸取液往往较多,所得浸取液中物质的浓度一般不会很大,因此用蒸发、结晶的方法不会得到晶体,它违背结晶法提纯物质的适用范围,所以不可行。(2)方案,得到浸出液后加入萃取剂将浸出物萃取浓缩,得到富含咖啡因的浓溶液,再蒸发水分,得到的是含杂质的晶体,应进一步纯化,不可行。(3)方案可行,蒸发溶剂(CCl4)得固体混合物,再加热升华纯化得到咖啡因。(4)方案不可行,因为咖啡因尚未从茶叶末中分离出来,重结晶得不到咖啡因晶体。正确方案为(3)。
苏教版 (2019)选择性必修1第一单元 弱电解质的电离平衡教课ppt课件: 这是一份苏教版 (2019)选择性必修1第一单元 弱电解质的电离平衡教课ppt课件,共13页。PPT课件主要包含了学习目标,交流讨论,课堂练习,77×10-5,80×10-5,421%,34%,21×10-3,34×10-3,电离平衡常数的意义等内容,欢迎下载使用。
化学选择性必修1第一节 电离平衡教学课件ppt: 这是一份化学选择性必修1第一节 电离平衡教学课件ppt,文件包含人教版化学选修一313《电离平衡常数》课件pptx、人教版化学选修一313《电离平衡常数》教学设计docx等2份课件配套教学资源,其中PPT共15页, 欢迎下载使用。
人教版 (新课标)选修6 实验化学第三单元 物质的检测综合与测试精品课件ppt: 这是一份人教版 (新课标)选修6 实验化学第三单元 物质的检测综合与测试精品课件ppt,共7页。PPT课件主要包含了答案C等内容,欢迎下载使用。













