


化学人教版 (新课标)第二章 分子结构与性质第二节 分子的立体构型备课ppt课件
展开1.能利用杂化轨道理论判断分子的立体构型。2.能说出配位键的形成条件,了解配位化合物及其应用。
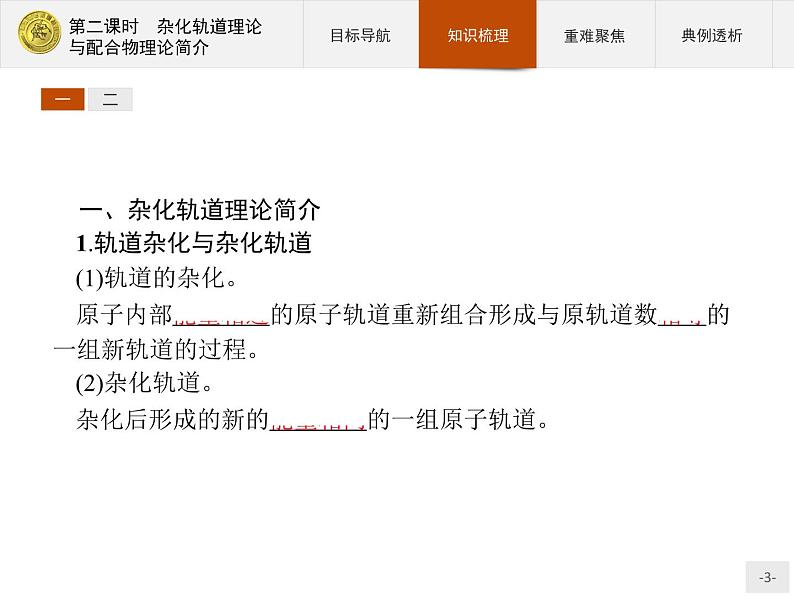
一、杂化轨道理论简介1.轨道杂化与杂化轨道(1)轨道的杂化。原子内部能量相近的原子轨道重新组合形成与原轨道数相等的一组新轨道的过程。(2)杂化轨道。杂化后形成的新的能量相同的一组原子轨道。
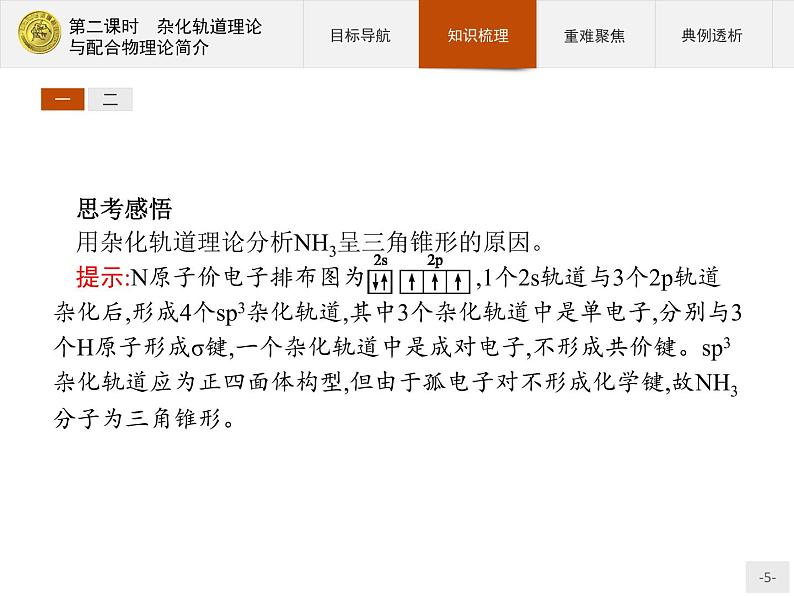
思考感悟用杂化轨道理论分析NH3呈三角锥形的原因。提示:N原子价电子排布图为 ,1个2s轨道与3个2p轨道杂化后,形成4个sp3杂化轨道,其中3个杂化轨道中是单电子,分别与3个H原子形成σ键,一个杂化轨道中是成对电子,不形成共价键。sp3杂化轨道应为正四面体构型,但由于孤电子对不形成化学键,故NH3分子为三角锥形。
二、配合物理论简介1.配位键(1)定义:共用电子对由一个原子单方面提供而与另一个原子形成的共价键,即“电子对给予-接受键”,是一类特殊的共价键。如在四水合铜离子中,铜离子与水分子之间的化学键是由水分子提供 孤电子对给予铜离子,铜离子接受水分子的孤电子对形成的。(2)表示:配位键可以用A→B来表示,其中A是给出孤电子对的原子,叫作给予体;B是接受电子对的原子,叫作接受体。
2.配位化合物(1)定义:通常把金属离子(或原子)与某些分子或离子(称为配体)以配位键结合形成的化合物称为配位化合物。如[Cu(H2O)4]2+中Cu2+称为中心离子,H2O称为配体,4称为配位数。
(2)配合物的形成举例:
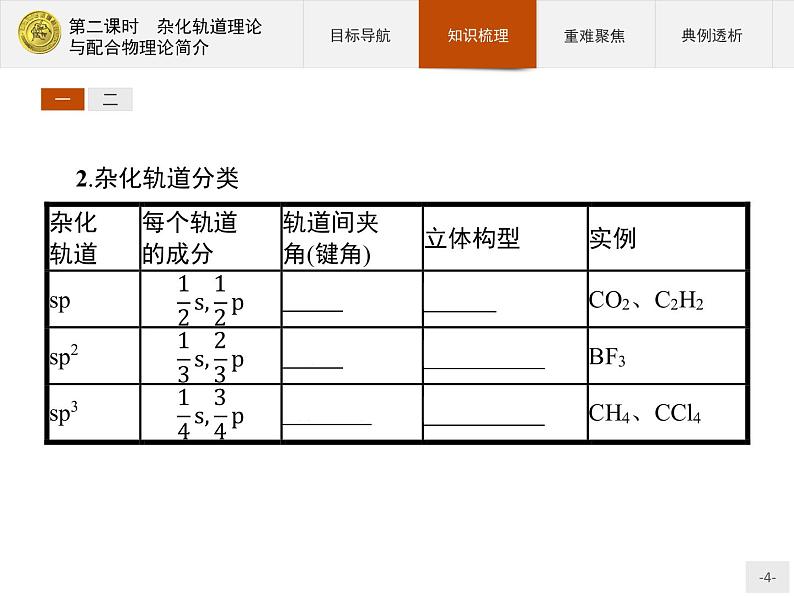
一、杂化轨道与分子的立体结构1.杂化轨道(1)杂化是指在形成分子时,由于原子间的相互影响,若干不同类型能量相近的原子轨道混合起来,重新组合成一组新轨道。(2)杂化的过程:电子激发→杂化→杂化轨道。(3)杂化轨道的数目等于参与杂化的原子轨道的总数。由于参与杂化的原子轨道的种类和数目不同,可以组成不同类型的杂化轨道。常见的有ns和np轨道形成的杂化轨道。(4)杂化轨道理论要点:①原子在成键时,同一原子中能量相近的原子轨道可重新组合成杂化轨道;②参与杂化的原子轨道数等于形成的杂化轨道数;③杂化改变了原子轨道的形状、方向,杂化使原子的成键能力增强。
2.分子的立体构型与杂化类型的关系(1)当杂化轨道全部用于形成σ键时:
(2)当杂化轨道中有未参与成键的孤电子对时:由于孤电子对参与互相排斥,会使分子的立体构型与杂化轨道的形状有所区别。如水分子中氧原子的sp3杂化轨道有2个是由孤电子对占据的,其分子不呈正四面体形,而呈V形;氨分子中氮原子的sp3杂化轨道有1个由孤电子对占据,氨分子不呈正四面体形,而呈三角锥形。特别提醒(1)杂化轨道间的夹角与分子内的键角不一定相同,中心原子杂化类型相同时孤电子对越多,键角越小。例如NH3中的氮原子与CH4中的碳原子均为sp3杂化,但键角分别为107°和109°28'。(2)杂化轨道与参与杂化的原子轨道数目相同,但能量不同。(3)杂化轨道也符合价层电子对互斥模型,应尽量占据整个空间,使它们之间的排斥力最小。
二、配合物及对物质性质的影响1.配位键共用电子对由成键原子单方面提供所形成的共价键称为配位键。特别提醒(1)配位键是一种特殊类型的共价键,但其性质、结构与共价键完全相同。(2)形成配位键的条件是:中心原子有空轨道,配体必须存在孤电子对。
2.配位化合物金属离子或原子与某些分子或离子(称为配体)以配位键结合而形成的化合物称为配位化合物。配位化合物的组成如图:
一般中心原子(或离子)的配位数为2、4、6、8。
(2)颜色的改变。当简单离子形成配离子时其性质往往有很大差异。颜色发生变化就是一种常见的现象,我们根据颜色的变化就可以判断是否有配离子生成。如Fe3+与SCN-在溶液中可生成配位数为1~6的铁的硫氰酸根配离子,这种配离子的颜色是红色的。(3)稳定性增强。配合物具有一定的稳定性,配合物中的配位键越强,配合物越稳定。当作为中心原子的金属离子相同时,配合物的稳定性与配体的性质有关。例如,血红素中的Fe2+与CO分子形成的配位键比Fe2+与O2分子形成的配位键强,因此血红素中的Fe2+与CO分子结合后,就很难再与O2分子结合,使血红素失去输送氧气的功能,从而导致人体CO中毒。
杂化轨道类型判断【例题1】 判断下列分子中中心原子的杂化类型。(1)NI3;(2)CH3Cl;(3)CO2;(4)SO2。答案:(1)sp3杂化 (2)sp3杂化 (3)sp杂化 (4)sp2杂化解析:由价电子对数判断:
点拨中心原子的杂化轨道数等于价层电子对数。注意:当被中心原子结合的原子为氧原子或硫原子时,可认为提供电子数为0;计算价电子数时,阳离子要减去电荷数;阴离子要加上电荷数。
利用杂化轨道理论解释分子的立体构型【例题2】 (1)BF3是平面三角形,但NF3却是三角锥形,试用杂化轨道理论加以解释。(2)在BF3、BeF2中B、Be原子各用哪几个原子轨道参与杂化?形成什么类型的杂化轨道?
答案:(1)BF3中硼原子以sp2杂化轨道与三个氟原子的各一个2p轨道重叠形成三个sp2-p的σ键。由于三个sp2杂化轨道在同一平面上,而且夹角为120°,所以BF3为平面三角形结构。而NF3分子中氮原子采用sp3杂化,有一对孤电子对占据一个杂化轨道,3个sp3杂化轨道与氟原子的2p轨道形成三个共价键,由于孤电子对占据四面体的一角,使NF3分子立体构型成为三角锥形。(2)硼原子参与杂化的原子轨道是一个2s和两个2p,形成三个sp2杂化轨道。Be原子参与杂化的原子轨道是一个2s和一个2p,形成两个sp杂化轨道。
点拨杂化类型的分析要借助于价层电子对互斥模型,利用价层电子对数等于杂化轨道数,确定杂化轨道数,再来确定需要杂化的轨道,最后根据孤电子对情况确定分子的立体构型。
高中化学人教版 (2019)选择性必修2第二节 分子的空间结构课文配套ppt课件: 这是一份高中化学人教版 (2019)选择性必修2第二节 分子的空间结构课文配套ppt课件,共19页。PPT课件主要包含了答案在课本中寻找,小组讨论,想一想,杂化轨道的特点,练一练等内容,欢迎下载使用。
人教版 (2019)选择性必修2第二节 分子的空间结构教课ppt课件: 这是一份人教版 (2019)选择性必修2第二节 分子的空间结构教课ppt课件,共31页。PPT课件主要包含了平面三角形,非极性,sp2,sp3,四面体形,K+和P3-等内容,欢迎下载使用。
高中化学人教版 (2019)选择性必修2第二节 分子的空间结构教案配套课件ppt: 这是一份高中化学人教版 (2019)选择性必修2第二节 分子的空间结构教案配套课件ppt,共54页。PPT课件主要包含了杂化轨道类型,杂化与杂化轨道,杂化过程的理解,问题探讨等内容,欢迎下载使用。













