


人教版 (新课标)选修3 物质结构与性质第一章 原子结构与性质综合与测试图文ppt课件
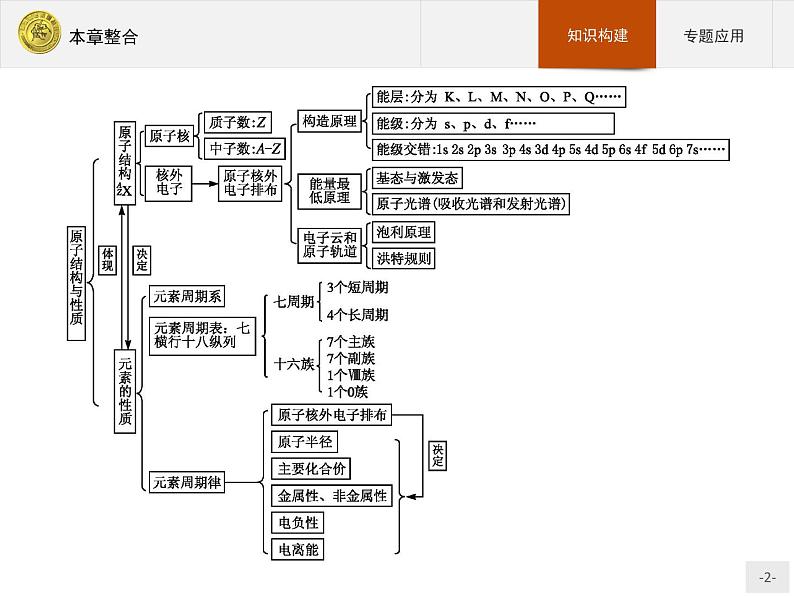
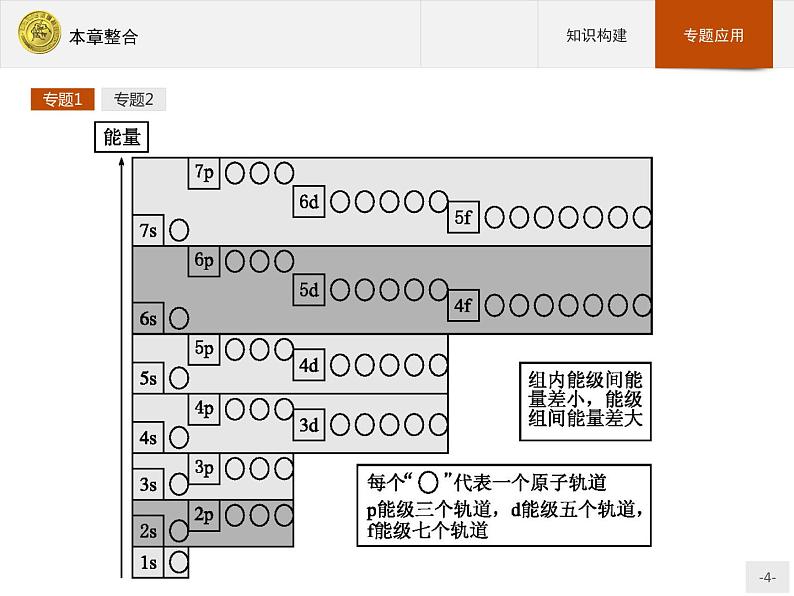
展开专题1 原子核外电子排布与元素周期律对于氢原子来说,在通常情况下,其核外的一个电子通常是位于基态的1s轨道上。但对于多电子原子来说,其核外电子是按能级顺序分层排布的。1.多电子原子轨道的能级在多电子原子中,由于电子间的相互排斥作用,原子轨道能级关系较为复杂。1939年鲍林(L.Pauling)根据光谱实验结果总结出多电子原子中各原子轨道能级的相对高低的情况,并用图近似地表示出来,称为鲍林近似能级图。
图中圆圈表示原子轨道,其位置的高低表示各轨道能级的相对高低,图中每一个方框中的几个轨道的能量是相近的,称为一个能级组。相邻能级组之间能量相差比较大。每个能级组(除第一能级组外)都是从s能级开始,于p能级终止。能级组序数等于核外电子层数。能级组的划分与周期表中周期的划分是一致的。从图中可以看出:(1)同一原子中的同一能层内,各能级之间的能量高低次序为ns
2.易混概念的比较原子结构与性质中,相似概念可以采用比较法学习,在比较中找差异,通过概念之间的差异加深理解,抓住本质,避免应用时出现错误。重点抓住下列概念的辨析与比较:
(1)电子层、次外层、最外层、最内层、内层在推断题中经常出现与层数有关的概念,理解这些概念是正确推断的关键。为了研究方便,人们形象地把原子核外电子运动看成分层运动,在原子结构示意图中,按能量高低将电子分为能层K、L、M、N、O、P、Q……统称为电子层。一个原子在基态时,电子所占据的电子层数等于该元素在周期表中所在的周期数。倒数第一层,称为最外层;从外向内,倒数第二层称为次外层;最内层就是第一层(K层),内层是除最外层外剩下的电子层的统称。以基态铁原子结构示意图为例: 铁原子共有4个电子层,最外层(N层)只有2个电子,次外层(M层)有14个电子,最内层(K层)有2个电子,内层共24个电子。
(2)基态、激发态基态指原子处于稳定状态,能量最低。基态原子核外电子排布遵循泡利原理、洪特规则、能量最低原理。激发态指原子接受能量,外围电子向较高能级跃迁。例如,碱金属原子的焰色反应,就是灼烧时,原子最外层电子向较高能级跃迁,冷却时又回到基态,在此过程中,“能量”以光能等形式释放。(3)价电子、最外层电子价电子指原子参加化学反应与元素化合价相关的电子,称为价态电子;最外层电子指电子层数最高的电子,对于主族元素,最外层电子数等于价电子数;对于副族元素,部分能量高的次外层电子参与成键,即次外层部分电子与最外层电子统称为价电子。
(4)能层、能级、轨道同一电子层称为同一能层,同一能层中能级能量有差异,同一能级中有多个轨道,其能量相同。例如,镍(Ni)原子电子排布式为1s22s22p63s23p63d84s2,其中1、2、3、4称为能层,2s、2p表明第2能层上有2个能级,即镍原子基态核外电子排布有4个能层,7个能级(1s、2s、2p、3s、3p、3d、4s)。轨道:s、p、d、f所含轨道数分别为1、3、5、7。1s、2s、3s、4s能级的能量不同,但是轨道数相同。电子进入能级的顺序是(按能量高低排序)1s<2s<2p<3s<3p<4s<3d<4p<5s<4d<5p<6s<4f<5d<6p<7s<5f<6d……在推断题中,常根据各能级中电子排布情况推断元素的原子序数,例如,某基态M3+核外电子排布式中3d能级半充满,推断该元素:M失去3个电子后得到的离子M3+中,3d能级半充满,表明能量低的轨道已排满,即M3+的电子排布式为1s22s22p63s23p63d5,M原子的质子数为26,M为铁。
【例题1】 在基态多电子原子中,关于核外电子能量的叙述错误的是( )A.最易失去的电子能量最高B.电离能最小的电子能量最高C.p轨道电子能量一定高于s轨道电子能量D.在离核最近区域内运动的电子能量最低答案:C解析:核外电子分层排布,电子总是尽可能地排布在能量最低的电子层里,离原子核越近,能量越低,离原子核越远,能量越高,因此选项A、B、D正确;在同一能层中,p轨道电子能量一定高于s轨道电子能量,但在不同能层中s轨道电子能量也可能高于p轨道电子能量,如E[(n+1)s]>E(np)。
专题2 同周期、同主族元素性质递变规律
【例题2】 下表是元素周期表的一部分,表中所对应的字母分别代表某一化学元素。 (1)下列 (填写编号)组元素的单质可能都是电的良导体。 ①a、c、h ②b、g、k ③c、h、l ④d、e、f
(2)如果给核外电子足够的能量,这些电子便会摆脱原子核的束缚而离去。核外电子离开该原子或离子所需要的能量主要受两大因素的影响。原子核失去核外不同电子所需的能量(kJ·ml-1)如下表:
①通过上述信息和表中的数据分析,为什么锂原子失去核外第二个电子时所需要的能量要远远大于失去第一个电子所需要的能量: 。 ②表中X可能为以上13种元素中的 (填写字母)元素。用元素符号表示X和j形成的化合物的化学式: 。③Y是周期表中 族的元素。 ④以上13种元素中, (填写字母)元素原子失去核外第一个电子需要的能量最多。 答案:(1)①④(2)①Li原子失去一个电子后形成稳定结构,此时再失去一个电子很困难②a Na2O和Na2O2③ⅢA ④m
解析:(1)从所给元素在周期表中的位置不难知道,a、c、d、f分别为Na、Mg、Sr和Al,e处于过渡元素区,也一定为金属,它们都是电的良导体;h为碳元素,其单质中的石墨也是电的良导体,故应选①④。(2)①锂原子核外共有三个电子,其中两个在K层,一个在L层,当失去最外层的一个电子后,锂离子达到稳定结构,根据题给信息可知,要使锂离子再失去电子便会形成不稳定结构,因此锂原子失去第二个电子时所需要的能量远远大于失去第一个电子所需要的能量。②由表中数据可知,X失去第二个电子所需要的能量远远大于失去第一个电子所需要的能量,故最外层只有一个电子。结合所给的周期表知,X应为a,即钠元素,与j(氧元素)所形成的化合物化学式分别为Na2O和Na2O2。
人教版 (新课标)选修1 化学与生活第四章 保护生存环境综合与测试多媒体教学课件ppt: 这是一份人教版 (新课标)选修1 化学与生活第四章 保护生存环境综合与测试多媒体教学课件ppt,共16页。PPT课件主要包含了专题1,专题2,专题3等内容,欢迎下载使用。
人教版 (新课标)选修1 化学与生活第三章 探索生活材料综合与测试图文课件ppt: 这是一份人教版 (新课标)选修1 化学与生活第三章 探索生活材料综合与测试图文课件ppt,共20页。PPT课件主要包含了专题1,专题2,专题3,金属的防护等内容,欢迎下载使用。
高中化学人教版 (新课标)选修4 化学反应原理第三章 水溶液中的离子平衡综合与测试多媒体教学ppt课件: 这是一份高中化学人教版 (新课标)选修4 化学反应原理第三章 水溶液中的离子平衡综合与测试多媒体教学ppt课件,共23页。PPT课件主要包含了专题1,专题2,专题3,专题4,答案A,答案B等内容,欢迎下载使用。













