
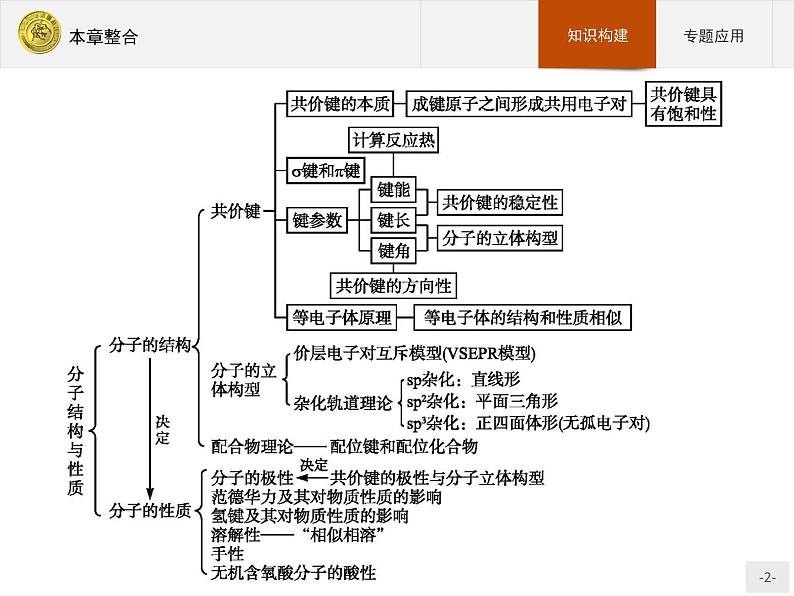



高中化学人教版 (新课标)选修3 物质结构与性质第二章 分子结构与性质综合与测试评课课件ppt
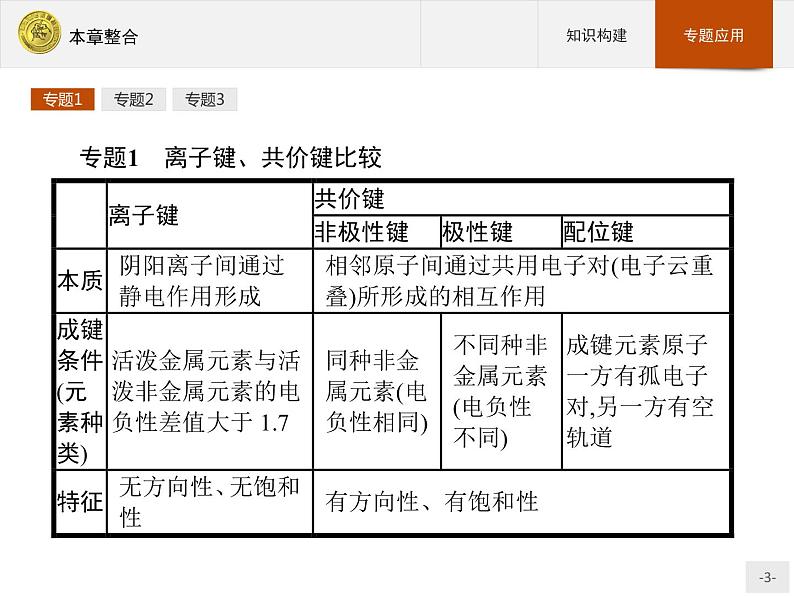
展开专题1 离子键、共价键比较
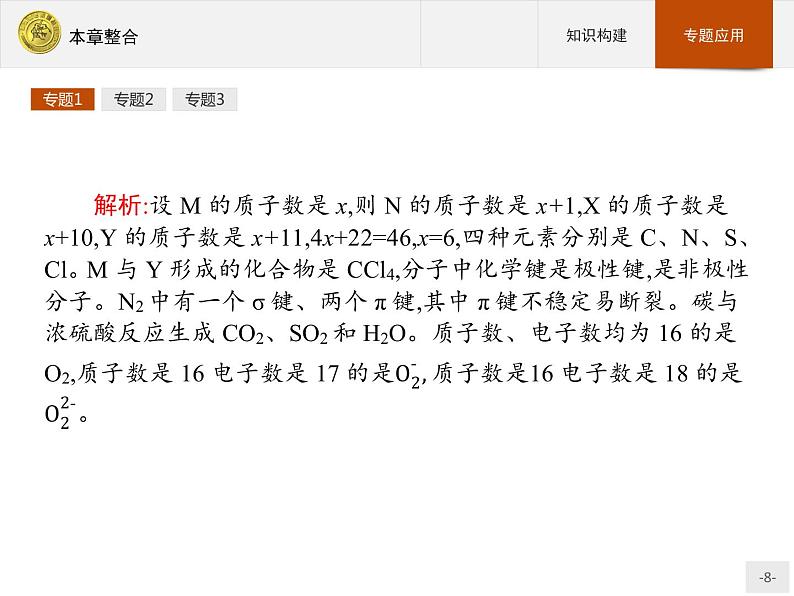
【例题1】 M、N、X、Y四种主族元素在周期表里的相对位置如图所示,已知它们的原子序数总和为46。
(1)M与Y形成的化合物中含 键,属 (填“极性”或“非极性”)分子。 (2)N元素形成的单质分子中的化学键类型(填“σ键”或“π键”)及数目是 。在化学反应中 易断裂。 (3)由N、Y的氢化物相互作用所生成的物质的电子式为 。其中的化学键有 。 (4)写出M单质与X元素最高价氧化物对应的水化物的浓溶液反应的化学方程式: 。
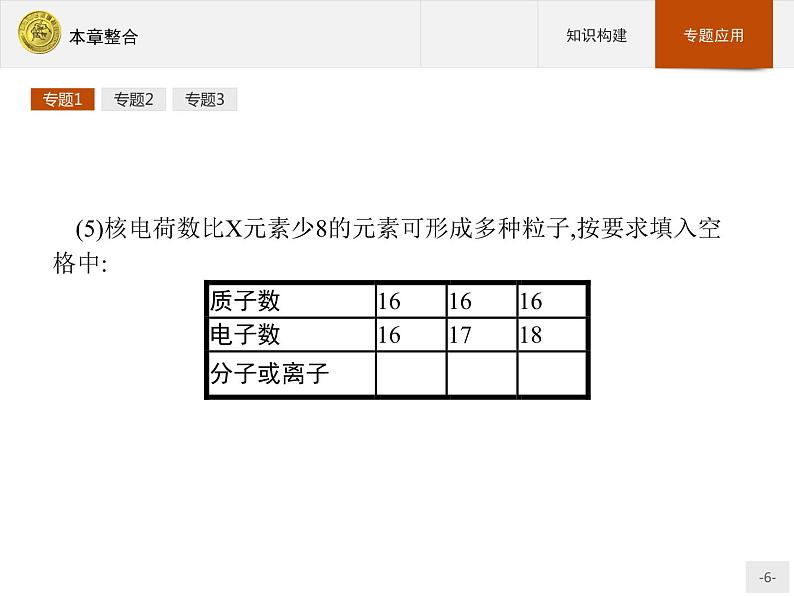
(5)核电荷数比X元素少8的元素可形成多种粒子,按要求填入空格中:
专题2 杂化轨道、价层电子对互斥与分子立体构型的关系1.杂化轨道类型与分子立体构型
2.价层电子对互斥理论判断共价分子结构的一般规则中心原子的价层电子对数与分子的立体构型有密切联系,对ABm型化合物,A的价层电子对数:
一般来讲,价电子数即为最外层电子数,但B为卤素、氢原子时,提供1个价电子;若为氧原子、硫原子时,则不提供电子;若有成单电子时,则看成电子对。价层电子对数与分子立体结构的关系:
如果价层电子对中有未成键的孤电子对,则分子立体结构发生相应的变化,用价层电子对理论解释。
3.一些常见分子的键角和立体构型
【例题2】 周期表前四周期的元素a、b、c、d、e,原子序数依次增大。a的核外电子总数与其周期数相同,b的价电子层中的未成对电子有3个,c的最外层电子数为其内层电子数的3倍,d与c同族;e的最外层只有1个电子,但次外层有18个电子。回答下列问题:(1)b、c、d中第一电离能最大的是 (填元素符号),e的价层电子排布图为 。 (2)a和其他元素形成的二元共价化合物中,分子呈三角锥形,该分子的中心原子的杂化方式为 ;分子中既含有极性共价键、又含有非极性共价键的化合物是 (填化学式,写出两种)。 (3)这些元素形成的含氧酸中,分子的中心原子的价层电子对数为3的酸是 ;酸根呈三角锥结构的酸是 。(填化学式)
(4)这5种元素形成的一种1∶1型离子化合物中,阴离子呈四面体结构;阳离子呈轴向狭长的八面体结构(如图所示)。该化合物中,阴离子为 ,阳离子中存在的化学键类型有 ; 该化合物加热时首先失去的组分是 ,判断理由是 。
解析:根据“a的核外电子总数与其周期数相同”可知a为H元素;根据“c的最外层电子数为其内层电子数的3倍”可知c为O元素;根据“b的价电子层中的未成对电子有3个”且原子序数:b>a,可知b为N元素;根据“d与c同族”可知d为S;根据“e的最外层只有1个电子,但次外层有18个电子”可知e为Cu。(1)由于O的非金属性比S强,故第一电离能O>S;由于N的2p轨道处于半充满的较稳定状态,故其第一电离能大于O,故N、O、S三种元素中,第一电离能最大的是N;Cu的价层电子排布图为 。(2)H可以和N形成三角锥形分子NH3,在NH3中,中心原子N原子的杂化方式为sp3杂化;H与N形成的N2H4,H与O形成的H2O2,都是既含有极性共价键又含有非极性共价键的分子。
专题3 共价键与分子极性的关系1.键的极性和分子的极性(1)极性分子中一定有极性键,而非极性分子中不一定只有非极性键。例如CH4是非极性分子,只有极性键。(2)含有非极性键的分子不一定为非极性分子,如H2O2是含有非极性键的极性分子。
2.判断ABn型分子极性的经验规律若中心原子A的化合价的绝对值等于该元素所在的主族序数,则为非极性分子;若不等则为极性分子,详见下表:
【例题3】 有以下物质:①HF ②Cl2 ③H2O ④N2 ⑤C2H4 ⑥C2H6 ⑦H2 ⑧H2O2 ⑨HCN ⑩CO2(1)只含有极性键的是 ;只含有非极性键的是 ;既有极性键又有非极性键的是 。 (2)只含有σ键的是 ;既有σ键又有π键的是 。 (3)含有非极性键的极性分子是 ,含有非极性键的非极性分子是 ,含有极性键的极性分子是 ,含有极性键的非极性分子是 。 答案:(1)①③⑨⑩ ②④⑦ ⑤⑥⑧(2)①②③⑥⑦⑧ ④⑤⑨⑩(3)⑧ ②④⑤⑥⑦ ①③⑧⑨ ⑤⑥⑩
人教版 (新课标)选修1 化学与生活第四章 保护生存环境综合与测试多媒体教学课件ppt: 这是一份人教版 (新课标)选修1 化学与生活第四章 保护生存环境综合与测试多媒体教学课件ppt,共16页。PPT课件主要包含了专题1,专题2,专题3等内容,欢迎下载使用。
人教版 (新课标)选修1 化学与生活第三章 探索生活材料综合与测试图文课件ppt: 这是一份人教版 (新课标)选修1 化学与生活第三章 探索生活材料综合与测试图文课件ppt,共20页。PPT课件主要包含了专题1,专题2,专题3,金属的防护等内容,欢迎下载使用。
化学选修1 化学与生活第二章 促进身心健康综合与测试授课课件ppt: 这是一份化学选修1 化学与生活第二章 促进身心健康综合与测试授课课件ppt,共15页。PPT课件主要包含了专题1,专题2,专题3等内容,欢迎下载使用。













