



高中化学人教版 (新课标)选修3 物质结构与性质第三章 晶体结构与性质综合与测试课文配套课件ppt
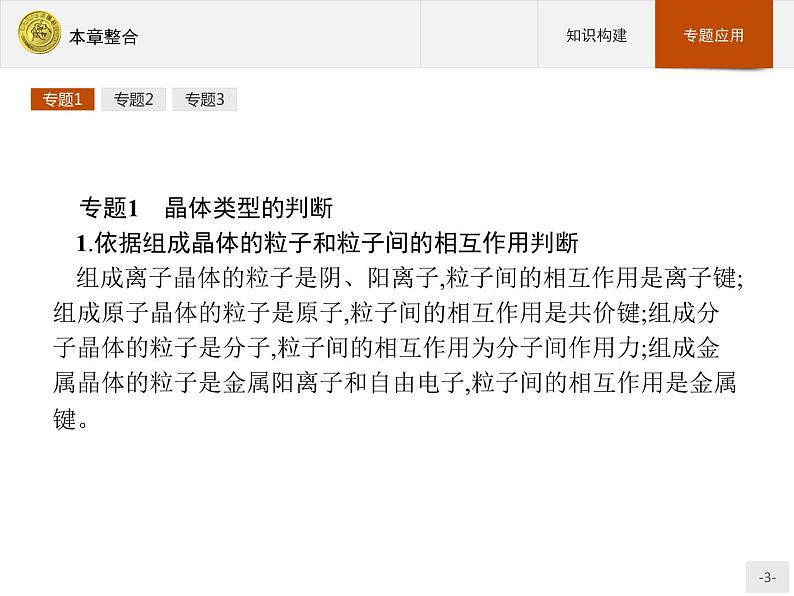
展开专题1 晶体类型的判断1.依据组成晶体的粒子和粒子间的相互作用判断组成离子晶体的粒子是阴、阳离子,粒子间的相互作用是离子键;组成原子晶体的粒子是原子,粒子间的相互作用是共价键;组成分子晶体的粒子是分子,粒子间的相互作用为分子间作用力;组成金属晶体的粒子是金属阳离子和自由电子,粒子间的相互作用是金属键。
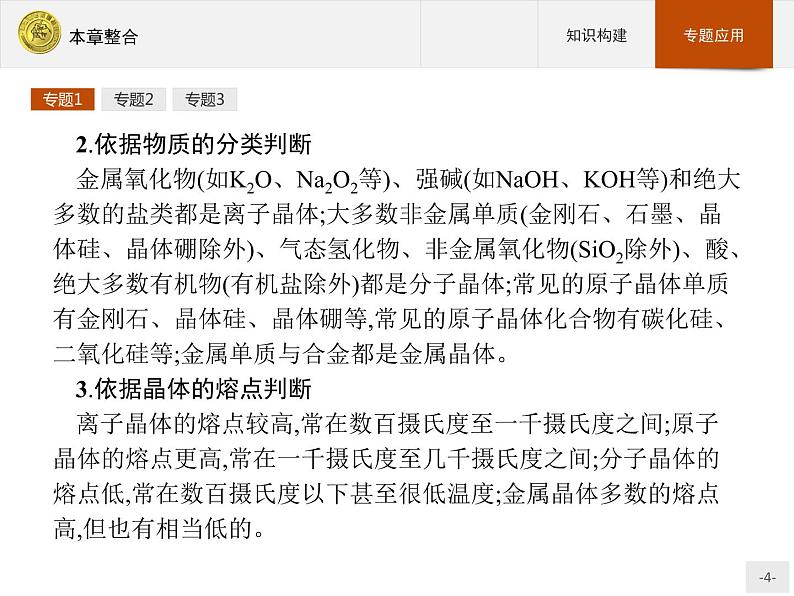
2.依据物质的分类判断金属氧化物(如K2O、Na2O2等)、强碱(如NaOH、KOH等)和绝大多数的盐类都是离子晶体;大多数非金属单质(金刚石、石墨、晶体硅、晶体硼除外)、气态氢化物、非金属氧化物(SiO2除外)、酸、绝大多数有机物(有机盐除外)都是分子晶体;常见的原子晶体单质有金刚石、晶体硅、晶体硼等,常见的原子晶体化合物有碳化硅、二氧化硅等;金属单质与合金都是金属晶体。3.依据晶体的熔点判断离子晶体的熔点较高,常在数百摄氏度至一千摄氏度之间;原子晶体的熔点更高,常在一千摄氏度至几千摄氏度之间;分子晶体的熔点低,常在数百摄氏度以下甚至很低温度;金属晶体多数的熔点高,但也有相当低的。
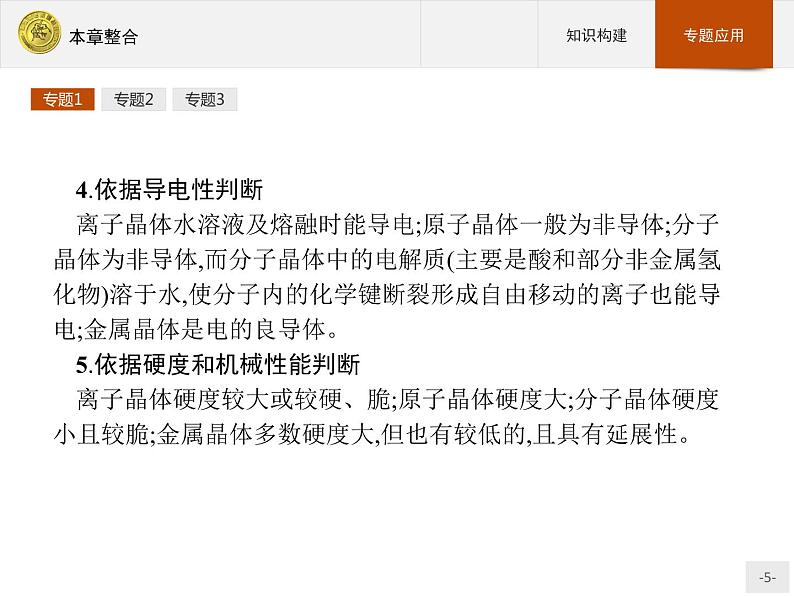
4.依据导电性判断离子晶体水溶液及熔融时能导电;原子晶体一般为非导体;分子晶体为非导体,而分子晶体中的电解质(主要是酸和部分非金属氢化物)溶于水,使分子内的化学键断裂形成自由移动的离子也能导电;金属晶体是电的良导体。5.依据硬度和机械性能判断离子晶体硬度较大或较硬、脆;原子晶体硬度大;分子晶体硬度小且较脆;金属晶体多数硬度大,但也有较低的,且具有延展性。
【例题1】 (1)分析下列物质的物理性质,判断其晶体类型:A.碳化铝,黄色晶体,熔点2 200 ℃,熔融态不导电 ; B.溴化铝,无色晶体,熔点98 ℃,熔融态不导电 ; C.五氟化钒,无色晶体,熔点19.5 ℃,易溶于乙醇、氯仿、丙酮中 ; D.溴化钾,无色晶体,熔融或溶于水中都能导电 。 (2)金属铁的晶体在不同温度下有两种堆积方式,晶胞分别如图所示。面心立方晶胞和体心立方晶胞中实际含有的铁原子个数之比为 。
答案:(1)原子晶体 分子晶体 分子晶体 离子晶体 (2)2∶1
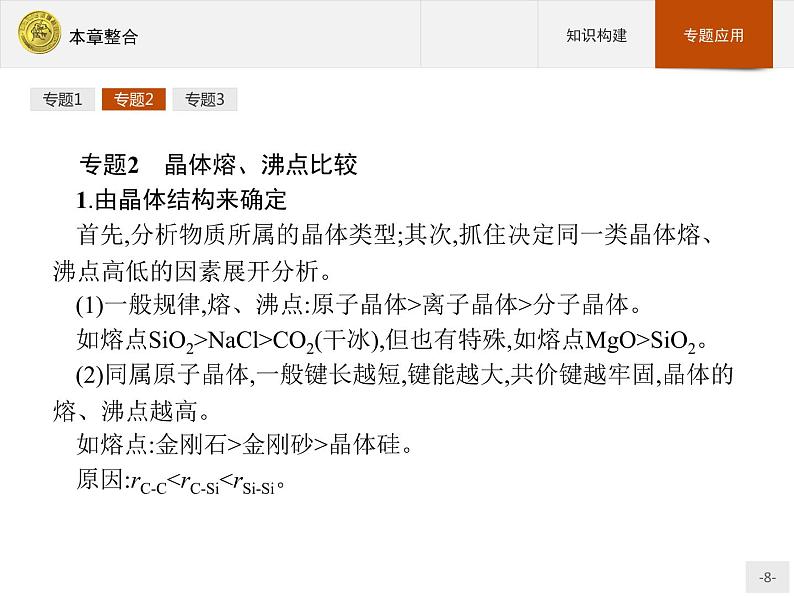
专题2 晶体熔、沸点比较1.由晶体结构来确定首先,分析物质所属的晶体类型;其次,抓住决定同一类晶体熔、沸点高低的因素展开分析。(1)一般规律,熔、沸点:原子晶体>离子晶体>分子晶体。如熔点SiO2>NaCl>CO2(干冰),但也有特殊,如熔点MgO>SiO2。(2)同属原子晶体,一般键长越短,键能越大,共价键越牢固,晶体的熔、沸点越高。如熔点:金刚石>金刚砂>晶体硅。原因:rC-C
【例题2】 下列各物质中,按熔点由高到低的顺序排列正确的是( )A.CH4>SiH4>GeH4>SnH4B.KCl>NaCl>MgCl2>MgOC.Rb>K>Na>LiD.石墨>金刚石>SiO2答案:D
解析:晶体熔点的高低取决于该晶体的结构和粒子间作用力的大小。A项物质均为结构相似的分子晶体,其熔点高低取决于分子间作用力的大小,一般来说,结构相似的分子晶体,相对分子质量越大,分子间作用力越大,熔点越高,故A项各物质熔点逐渐升高;B项物质均为离子晶体,离子晶体熔点高低取决于晶格能的大小,一般来说,离子的半径越小,电荷数越多,晶格能就越大,熔点越高,故B项各物质熔点也逐渐升高;C项物质均为同主族的金属晶体,其熔点高低取决于金属键的强弱,而金属键的强弱与金属原子半径成反比,与价电子数成正比,碱金属原子半径依Li~Rb的顺序增大,价电子数相同,故熔点应是Li最高,Rb最低;D项,石墨是混合晶体,金刚石和SiO2均为原子晶体,原子晶体的熔点取决于共价键的键能,而共价键的键能与键长成反比,石墨中C—C键键长比金刚石中C—C键的键长更短些,所以石墨熔点比金刚石略高,金刚石熔点又比SiO2高。
专题3 晶胞组成的计算方法——分割法
特别提醒(1)具有规则几何外形的固体不一定是晶体,如玻璃制品;(2)晶胞是从晶体中“截取”出来具有代表性的最小单元,而不一定是最小的“平行六面体”;(3)在计算晶胞中微粒个数的过程中,不是任何形状的晶胞均可使用均摊法,注意分析不同位置的微粒被几个晶胞共有。
【例题3】 铜是重要金属,Cu的化合物在科学研究和工业生产中具有许多用途,如CuSO4溶液常用作电解液、电镀液等。请回答下列问题:(1)CuSO4可由金属铜与浓硫酸反应制备,该反应的化学方程式为 ; (2)CuSO4粉末常用来检验一些有机物中的微量水分,其原因是 ;
答案:(1)Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O(2)白色CuSO4粉末和水结合生成蓝色的CuSO4·5H2O晶体(3)正四面体形 sp3杂化(4)6s1 3∶1 金属键 (5)Cu3AuH8
人教版 (2019)选择性必修3第五章 合成高分子本章综合与测试评课ppt课件: 这是一份人教版 (2019)选择性必修3第五章 合成高分子本章综合与测试评课ppt课件,共1页。
人教版 (新课标)选修1 化学与生活第三章 探索生活材料综合与测试图文课件ppt: 这是一份人教版 (新课标)选修1 化学与生活第三章 探索生活材料综合与测试图文课件ppt,共20页。PPT课件主要包含了专题1,专题2,专题3,金属的防护等内容,欢迎下载使用。
化学选修1 化学与生活第二章 促进身心健康综合与测试授课课件ppt: 这是一份化学选修1 化学与生活第二章 促进身心健康综合与测试授课课件ppt,共15页。PPT课件主要包含了专题1,专题2,专题3等内容,欢迎下载使用。













