




化学选修4 化学反应原理第三章 水溶液中的离子平衡第一节 弱电解质的电离示范课课件ppt
展开1.能说出电解质的概念,了解强电解质和弱电解质的概念。2.能应用化学平衡理论描述弱电解质在水溶液中的电离平衡。3.能说出电离平衡的影响因素。
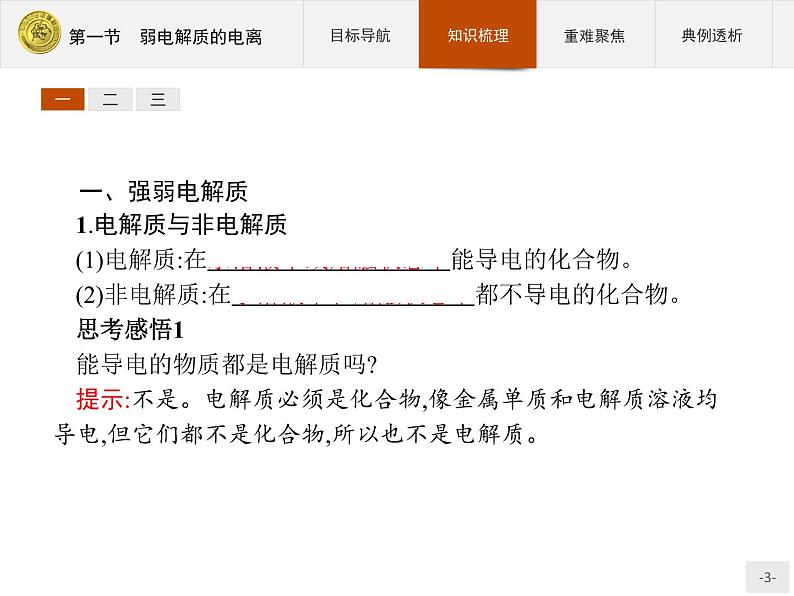
一、强弱电解质1.电解质与非电解质(1)电解质:在水溶液中或熔融状态下能导电的化合物。(2)非电解质:在水溶液中和熔融状态下都不导电的化合物。思考感悟1能导电的物质都是电解质吗?提示:不是。电解质必须是化合物,像金属单质和电解质溶液均导电,但它们都不是化合物,所以也不是电解质。
2.强电解质和弱电解质(1)强电解质。①定义:在水溶液中能够全部电离的电解质。②常见的强电解质:强酸、强碱和大部分的盐。(2)弱电解质。①定义:在水溶液中不能全部电离的电解质。②常见的弱电解质:弱酸、弱碱和水。思考感悟2难溶的电解质都是弱电解质,易溶的电解质都是强电解质吗?提示:不是。难溶、易溶是指物质溶解度的大小,而强电解质和弱电解质是根据电解质在水中的电离程度区分的,这是两个不同的概念,无必然的联系。
二、弱电解质的电离平衡1.电离平衡在一定条件(如温度、浓度一定)下,弱电解质在溶液中 电离成离子的速率和离子结合成分子的速率相等,电离过程就达到了平衡状态。 思考感悟3弱电解质达到电离平衡后,还会继续电离吗?提示:一定条件下,弱电解质达到电离平衡后,还会继续电离,只是电离成离子的速率和离子结合成分子的速率相等。
2.弱电解质电离方程式的书写(1)弱酸、弱碱在水溶液中电离,在熔融态下弱酸不电离,绝大多数弱碱受热易分解。
三、电离常数1.表示方法 2.K的意义表示弱电解质的电离能力。一定温度下,K值越大,弱电解质的电离程度越大。多元弱酸只考虑第一步电离。3.影响因素K只与电解质的性质和温度有关,对同一弱电解质,温度一定,电离常数一定;温度升高时,电离常数增大。
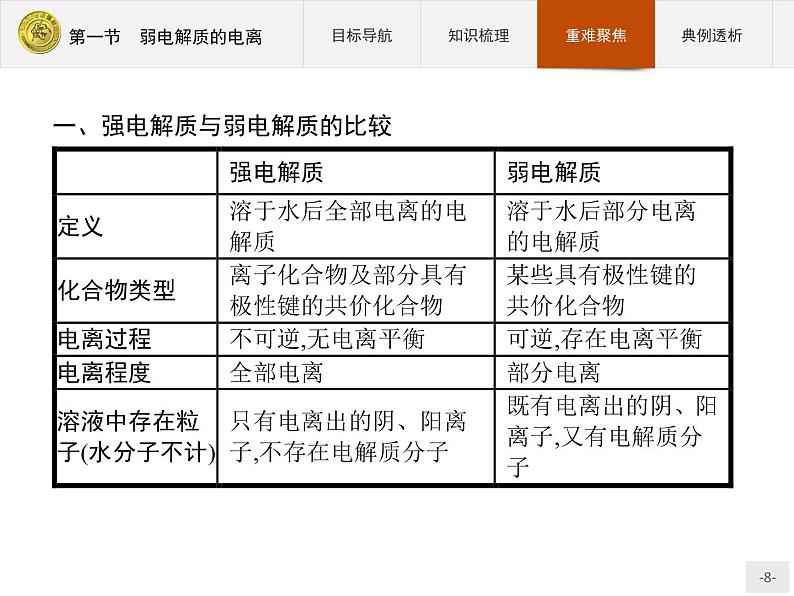
一、强电解质与弱电解质的比较
特别提醒判断某一物质是强电解质还是弱电解质时,只能根据其是否完全电离进行判断,而不能根据溶液中离子浓度的大小或溶液导电能力的强弱进行判断。
二、电离方程式的书写
三、弱电解质电离平衡的影响因素1.主要影响因素:电解质本身的相对强弱。2.外界条件对电离平衡的影响:
特别提醒(1)弱电解质的电离平衡同化学平衡类似,可应用勒夏特列原理解释有关电离平衡移动的问题。(2)条件改变时,电离平衡会发生移动,但电离常数(K)不一定改变,只有当温度改变时,K才改变。
强弱电解质的判断【例题1】 下列物质的分类组合全部正确的是( ) 解析:A、C选项中的Cu、Cl2是单质,既不是电解质,也不是非电解质;D选项中的CH3COOH是弱电解质。答案:B
点拨电解质和非电解质的范畴都是化合物,所以单质既不是电解质,也不是非电解质。划分电解质和非电解质的标准是在水溶液中或熔融状态下能否导电。划分强电解质和弱电解质的标准是看在水溶液里是否完全电离。
【例题2】 下列关于强弱电解质的叙述错误的是( )A.弱电解质在溶液中部分电离,存在电离平衡B.在溶液中导电能力强的电解质是强电解质,导电能力弱的电解质是弱电解质C.同一弱电解质的溶液,当温度、浓度不同时,其导电能力也不相同D.纯净的强电解质在液态时,有的导电,有的不导电
解析:强电解质在溶液中完全电离,不存在电离平衡,弱电解质在溶液中部分电离,存在电离平衡,A正确;强电解质和弱电解质是由电解质在溶液中的电离程度区分的,而溶液导电能力取决于溶液中自由移动离子的浓度及离子所带电荷的多少,所以强电解质溶液的导电能力不一定强,弱电解质溶液的导电能力不一定弱,B错误;同一弱电解质的溶液,当温度、浓度不同时,其电离程度不同,溶液中离子浓度不同,其导电能力也不相同,C正确;若强电解质是离子化合物,其液态时导电,若强电解质是共价化合物,其液态时不导电,D正确。答案:B
点拨对强电解质和弱电解质的正确理解(1)区分电解质强弱的唯一依据是电解质在水溶液中能否完全电离,即电离程度。(2)电解质的强弱与溶液导电性的强弱无必然联系。相同条件下溶液中离子浓度大的导电能力强,离子电荷越高,导电能力越强。(3)电解质的强弱与物质的溶解性无必然联系。即使溶解度很小,只要溶于水的部分完全电离就是强电解质,所以不能根据溶解度大小进行判断。(4)在强弱电解质的判断中还要特别注意其概念的研究范畴——化合物,溶液、单质即使导电也不是电解质。
弱电解质电离平衡的影响因素【例题3】 H2S是二元弱酸。在其水溶液中,通入或加入少量的下列物质:①HCl ②NH3 ③NaHS固体 ④Na固体。能使溶液中的c(H+)增大的是( )A.①②B.②④C.③④D.①
2020-2021学年第一节 弱电解质的电离授课ppt课件: 这是一份2020-2021学年第一节 弱电解质的电离授课ppt课件,共29页。PPT课件主要包含了电解质,非电解质,强电解质,弱电解质,③④⑨,课堂练习,②③⑥⑦⑧⑨⑩,②③⑥⑧⑩,④酸式盐的电离,习题9等内容,欢迎下载使用。
人教版 (新课标)选修4 化学反应原理第一节 弱电解质的电离教课内容ppt课件: 这是一份人教版 (新课标)选修4 化学反应原理第一节 弱电解质的电离教课内容ppt课件,共11页。PPT课件主要包含了电离平衡的特点,动动态平衡,加入其它电解质,电离度α,K越大等内容,欢迎下载使用。
高中化学人教版 (新课标)选修4 化学反应原理第一节 弱电解质的电离教学课件ppt: 这是一份高中化学人教版 (新课标)选修4 化学反应原理第一节 弱电解质的电离教学课件ppt,共29页。PPT课件主要包含了强电解质,弱电解质,③④⑨,课堂练习,②③⑥⑦⑧⑨⑩,②③⑥⑧⑩,④酸式盐的电离,习题9,习题10,P41思考与交流等内容,欢迎下载使用。













