



人教版 (新课标)选修4 化学反应原理第二节 水的电离和溶液的酸碱性课文配套课件ppt
展开第1课时 水的电离和溶液的酸碱性
1.理解水的电离。2.会运用水的离子积常数进行简单计算。3.会运用溶液的酸碱性与pH的定义处理问题。
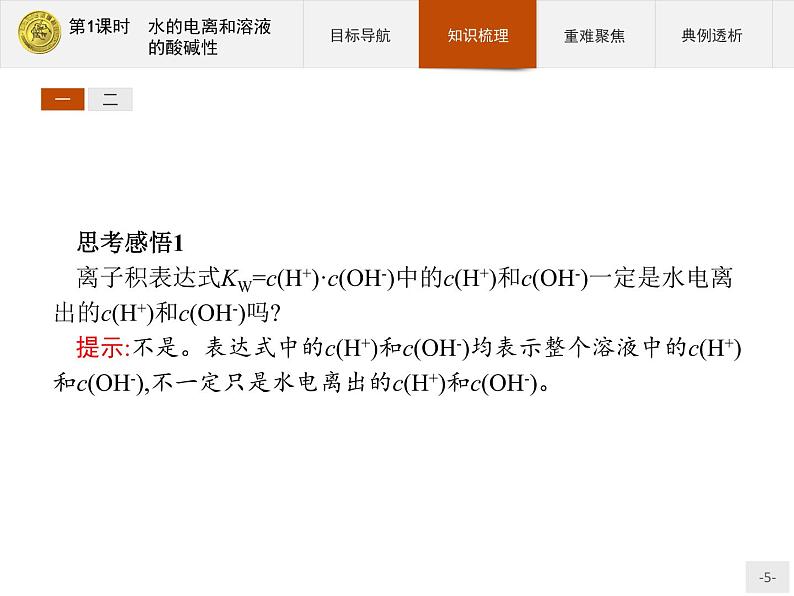
思考感悟1离子积表达式KW=c(H+)·c(OH-)中的c(H+)和c(OH-)一定是水电离出的c(H+)和c(OH-)吗?提示:不是。表达式中的c(H+)和c(OH-)均表示整个溶液中的c(H+)和c(OH-),不一定只是水电离出的c(H+)和c(OH-)。
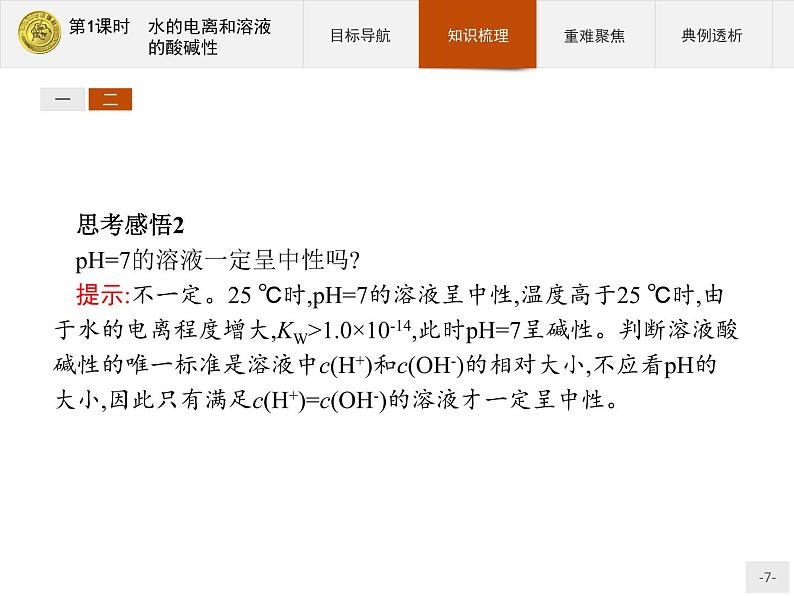
二、溶液的酸碱性与pH1.判断溶液酸碱性的依据c(H+)和c(OH-)的相对大小。2.溶液酸碱性与溶液中c(H+)和c(OH-)的关系c(H+)=c(OH-),溶液呈中性;c(H+)>c(OH-),溶液呈酸性,且c(H+)越大,酸性越强;c(H+)
4.溶液pH的测定方法溶液pH的测定方法有pH试纸法、pH计法。
一、影响水的电离平衡的因素
特别提醒(1)不同的溶液中,c(H+)与c(OH-)不一定相等,但由水电离产生的c(H+)与c(OH-)一定相等,判断溶液中水的电离程度时,酸溶液看c(OH-),碱溶液看c(H+)。(2)25 ℃,任何稀的电解质水溶液中c(H+)·c(OH-)=KW这一关系不变,当改变其他条件使c(H+)增大时,c(OH-)必然降低,反之亦然。
二、溶液的酸碱性与pH1.溶液酸碱性、c(H+)、c(OH-)、pH对照表
2.25 ℃时,溶液酸碱性与c(H+)、pH的关系图示(1)图示: (2)相关说明,溶液中c(H+)越小,c(OH-)越大,溶液的酸性越弱,碱性越强,pH越大;溶液中c(H+)越大,c(OH-)越小,溶液的酸性越强,碱性越弱,pH越小。
3.溶液pH的测定方法(1)用酸碱指示剂测定:只能粗略测定溶液酸碱性,即pH的大致范围。常见酸碱指示剂的变色范围如下:
(2)用pH试纸测定:试纸显红色表示溶液为酸性,且红色越深表示溶液酸性越强,pH越小;试纸显蓝色表示溶液为碱性,且蓝色越深表示溶液碱性越强,pH越大。(3)用pH计测定:pH计是一种精密仪器,能够精确测定溶液的pH。
特别提醒用pH试纸测定溶液的pH时,玻璃棒必须洁净、干燥,不能润湿,试纸也不能润湿,因为润湿后会改变溶液的浓度,使测定的pH可能发生偏差。另外,用试纸测定的pH一般取整数,且读数应在半分钟内完成。
水的电离及其影响因素【例题1】 下列操作中,能使电离平衡H2O H++OH-向右移动且溶液呈碱性的是( )A.向水中加入NaHSO4溶液B.向水中加入少量金属钠C.向水中加入NaOH溶液D.将水加热到100 ℃,使pH=6解析:向水中加入NaHSO4溶液,溶液中c(H+)增大,抑制水的电离,平衡向左移动,A错误;向水中加入少量金属钠,消耗水电离产生的H+,使水的电离平衡向右移动,c(OH-)增大,溶液呈碱性,B正确;向水中加入NaOH溶液,溶液中c(OH-)增大,抑制水的电离,平衡向左移动,C错误;将水加热到100 ℃,使pH=6,但c(H+)=c(OH-),溶液呈中性,D错误。答案:B
点拨促进或抑制水电离的因素(1)促进水电离的因素有升温、加入能消耗H+或OH-的物质(如加活泼金属)。(2)抑制水电离的因素有降温、加入酸(或强酸的酸式盐)、加入碱。
【例题2】 已知25 ℃时水的离子积为KW=1.0×10-14,35 ℃时水的离子积为KW=2.1×10-14。下列说法中正确的是( )A.水中的c(H+)随温度的升高而降低B.25 ℃时水呈中性,35 ℃时水呈酸性C.水的电离过程是吸热过程D.一定温度下,向水中加入酸或碱时,水的离子积将发生变化解析:温度越高,水的电离程度越大,c(H+)越大,A不正确;纯水在任何温度下都是中性的,B不正确;电离过程一般是吸热的,水的电离是中和反应的逆过程,为吸热过程,C正确;水的离子积只与温度有关,与溶液浓度无关,D不正确。答案:C
点拨一定温度下,当向水中加入酸或碱时,溶液中的c(H+)或c(OH-)要发生变化,但当c(H+)增大时,c(OH-)必然减小,当c(OH-)增大时,c(H+)必然减小,二者的乘积仍保持不变,即温度不变,离子积常数不会变化。
溶液的酸碱性与pH【例题3】 下列关于溶液酸碱性的说法正确的是( )A.pH=7的溶液是中性B.中性溶液中一定有c(H+)=1.0×10-7 ml·L-1C.c(H+)=c(OH-)的溶液是中性D.在100 ℃时,纯水的pH<7,因此显酸性解析:运用pH判断溶液的酸碱性时,要用到水的离子积常数,它与温度有关,但A项未给出温度,所以错误;在中性溶液中,c(H+)和c(OH-)一定相等,但并不一定c(H+)=c(OH-)=1.0×10-7 ml·L-1,所以B项错误,C项正确;在100 ℃的纯水中,虽然pH<7,但c(H+)=c(OH-),还是中性,所以D项错误。答案:C
高中化学人教版 (2019)选择性必修3第二节 醇酚优秀课件ppt: 这是一份高中化学人教版 (2019)选择性必修3<a href="/hx/tb_c4002469_t3/?tag_id=26" target="_blank">第二节 醇酚优秀课件ppt</a>,共33页。PPT课件主要包含了探究醇和酚,任务一,CH3CH2OH,苯甲醇,邻甲基苯酚,-丙醇异丙醇,-丙醇正丙醇,探究醇的分类,任务二,羟基数目等内容,欢迎下载使用。
高中化学第二节 水的电离和溶液的酸碱性示范课课件ppt: 这是一份高中化学第二节 水的电离和溶液的酸碱性示范课课件ppt,共25页。PPT课件主要包含了复习巩固,思考与交流,正反应吸热,水的电离,问题与讨论,加入酸,平衡逆向移动,但Kw保持不变,CH+,COH-等内容,欢迎下载使用。
2021学年第二节 水的电离和溶液的酸碱性课文ppt课件: 这是一份2021学年第二节 水的电离和溶液的酸碱性课文ppt课件,共60页。PPT课件主要包含了复习巩固,思考与交流,水是极弱的电解质,加入酸,平衡逆向移动,但Kw保持不变,CH+,COH-,加入碱,升高温度等内容,欢迎下载使用。













