




高中化学第二章 化学反应速率和化学平衡综合与测试备课ppt课件
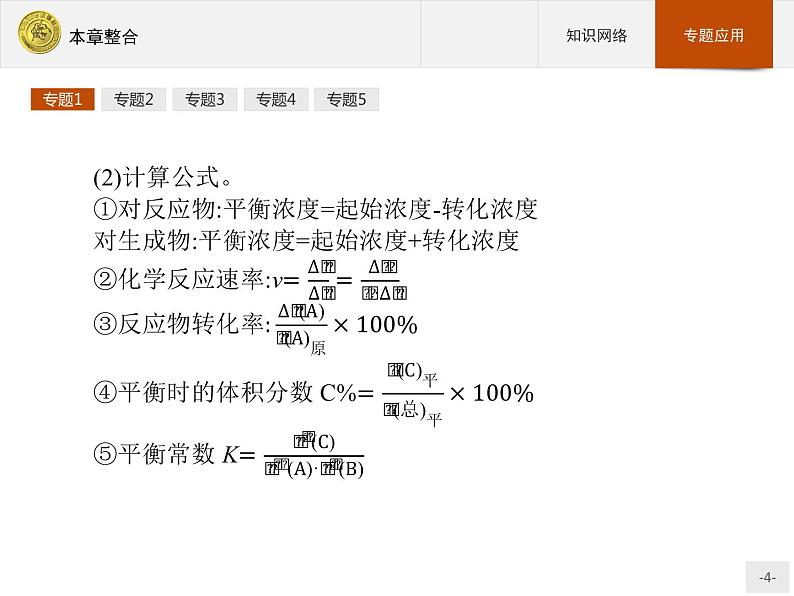
展开化学反应速率和化学平衡的相关计算化学反应速率和化学平衡相关计算的步骤和模式(1)计算模式(三段式)。
【例题1】 将2 ml SO2和1 ml O2混合置于体积可变、压强恒定的密闭容器中,在一定温度下发生如下反应:2SO2(g)+O2(g) 2SO3(g) ΔH<0当反应进行到时间t1时达到平衡状态,测得混合气体总物质的量为2.1 ml。试回答下列问题:(1)反应进行到t1时,SO2的体积分数为 。 (2)若在t1时充入一定量的氩气(Ar),SO2的物质的量将 (填“增大”“减小”或“不变”)。 (3)若在t1时升温,重新达到平衡状态,新平衡混合物中气体的总物质的量 (填“<”“>”或“=”)2.1 ml,并简单说明原因: 。
解析:(1) 2SO2(g)+O2(g) 2SO3(g)起始(ml)210转化(ml)2xx2x平衡(ml)2-2x1-x 2x即:2-2x+1-x+2x=2.1,所以:x=0.9。平衡时n(SO2)=2 ml-0.9×2 ml=0.2 ml,所以SO2的体积分数等于其物质的量分数为(2)t1时充入氩气,由于保持压强不变,体积增大,等效于减压,平衡逆向移动,n(SO2)增大。(3)t1时升温,平衡逆向移动,因此新平衡体系中气体总物质的量大于2.1 ml。
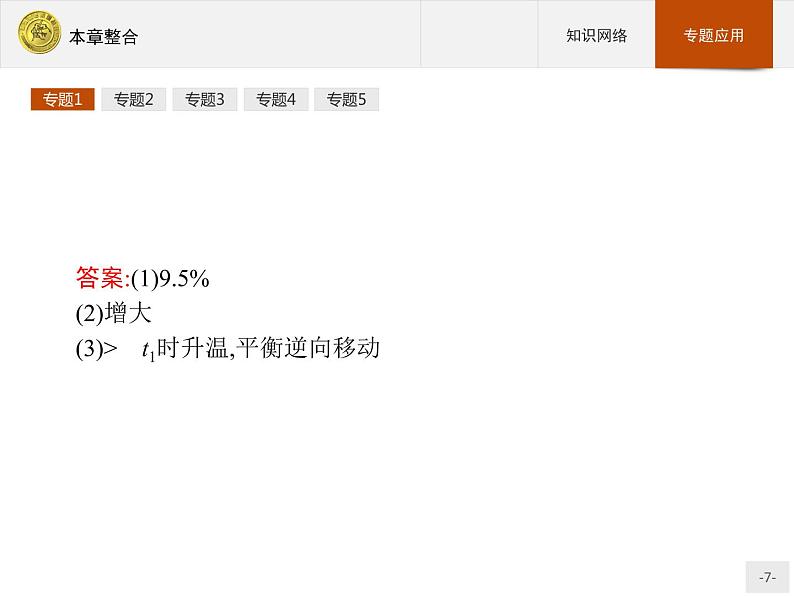
答案:(1)9.5%(2)增大(3)> t1时升温,平衡逆向移动
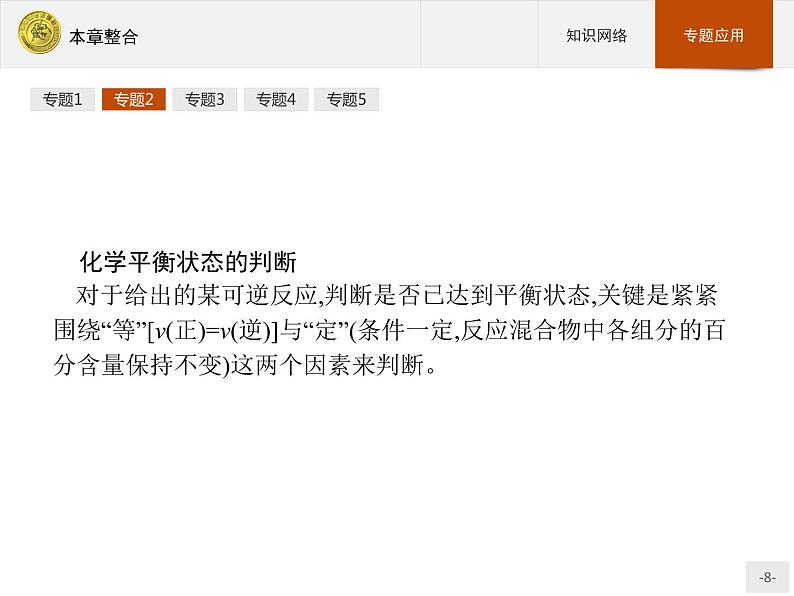
化学平衡状态的判断对于给出的某可逆反应,判断是否已达到平衡状态,关键是紧紧围绕“等”[v(正)=v(逆)]与“定”(条件一定,反应混合物中各组分的百分含量保持不变)这两个因素来判断。
【例题2】 (1)下列方法中可以证明2HI(g) H2(g)+I2(g)已达平衡状态的是 (填序号)。 ①单位时间内生成n ml H2的同时生成n ml HI②一个H—H键断裂的同时有两个H—I键断裂③I2与HI的浓度相等时④反应速率 ⑤c(HI)∶c(H2)∶c(I2)=2∶1∶1时⑥温度和体积一定时,某一生成物浓度不再变化时⑦温度和体积一定时,容器内压强不再变化时⑧条件一定,混合气体的平均相对分子质量不再变化时⑨温度和体积一定时,混合气体的颜色不再变化时⑩温度和压强一定时,混合气体的密度不再变化时(2)在上述⑥~⑩的说法中,能说明2NO2(g) N2O4(g)达到平衡状态的是 。
解析:由第(1)题反应的特征可知:此反应在反应前后气体的体积不发生变化,即在反应的任何一个阶段,容器内压强不发生改变。气体的总质量不变、总的物质的量不变,因此混合气体的密度、平均相对分子质量均不发生改变。由第(2)题反应的特征:反应前后气体体积发生改变,因此若平衡发生移动,则其平均相对分子质量、混合气体密度都发生改变,当反应处于平衡状态时,这些都不再改变,此时c(NO2)恒定,颜色不再变化。答案:(1)②⑥⑨ (2)⑥⑦⑧⑨⑩点拨判断化学平衡状态时要抓住“v(正)=v(逆)”和“各组分的百分含量保持不变”这两个核心判据。
外界条件对反应物转化率的影响1.温度的影响若正反应是吸热反应,升高温度,反应物转化率增大;降低温度,反应物转化率减小;若正反应为放热反应,升高温度,反应物转化率减小;降低温度,反应物转化率增大。
2.压强的影响对于mA(g)+nB(g) pC(g)+qD(g)(1)若m+n>p+q时,压强增大,A、B的转化率增大;压强减小,A、B的转化率减小。(2)若m+n
【例题4】 据报道,在300 ℃、70 MPa下由二氧化碳和氢气合成乙醇已成为现实,2CO2(g)+6H2(g) CH3CH2OH(g)+3H2O(g)。下列叙述错误的是( )A.使用Cu-Zn-Fe催化剂可大大提高生产效率B.由反应需在300 ℃下进行可推测该反应是吸热反应C.充入大量CO2气体可提高H2的转化率D.从平衡混合气体中分离出CH3CH2OH和H2O可提高CO2和H2的利用率解析:A项,催化剂能加快化学反应速率,提高生产效率;B项,判断吸热反应和放热反应是根据体系能量的变化,不能根据反应条件;C项,充入大量CO2气体,平衡正向移动,H2的转化率提高;D项,平衡正向移动,可提高CO2和H2的利用率。答案:B
化学平衡常见图像分析1.物质的量浓度与时间图像由这类图像可书写化学方程式。
2.体积分数与时间、温度、压强的图像
由(1)可知,T1温度先达到平衡,故T1 >T2,升温,φ(C)增大,ΔH>0。由(2)可知,T2温度先达到平衡,故T1
【例题5】 在某密闭容器中,可逆反应:A(g)+B(g) xC(g)符合图中(Ⅰ)所示关系,φ(C)表示C气体在混合气体中的体积分数。由此判断,对图像(Ⅱ)说法不正确的是 ( ) A.p3>p4,Y轴表示A的转化率B.p3>p4,Y轴表示B的质量分数C.p3>p4,Y轴表示B的转化率D.p3>p4,Y轴表示混合气体的平均相对分子质量
解析:据图像(Ⅰ)知,在压强不变时,曲线b的斜率比c的大,故T1>T2。降温(T1→T2)时,φ(C)增大,即平衡正向移动,说明正反应为放热反应。当温度不变时,曲线b的斜率比a的大,故压强p2>p1,增大压强(p1→p2)时,φ(C)增大,即平衡正向移动,故x<2,即x=1。由图像(Ⅱ)知,保持体系压强不变,升高温度,平衡逆向移动,A和B的转化率、φ(C)、混合气体的平均相对分子质量均减小,而A和B的质量分数要增大。答案:B
点拨解答平衡图像题可采用如下模式:(1)先分析反应的特点(是放热反应还是吸热反应,是气体体积增大的反应还是气体体积缩小的反应等)。一定要抓住图像中的改变条件——瞬间所引起的浓度、压强、速率的变化,再针对改变各种条件时引起的变化的特征进行对照分析。(2)再分析图像所表达的各个量之间的关系(两个坐标轴各表示什么物理量,曲线的变化趋势如何,是单一曲线还是多条曲线,曲线上的关键点,如起点、拐点、交点、终点的含义是什么等)。
关于“等效平衡”问题解等效平衡问题,应看清两点:一是看清反应的条件:等温、等压或等温、等容;二是看清反应的特点。对于反应前后气体物质的量不变的可逆反应,无论在什么条件下,只要温度一定,配比与原来相同即可建立等效平衡;而对于反应前后气体物质的量发生变化的可逆反应,则要分两种情况讨论:①等温、等压条件下化归原比值;②等温、等容条件下化归原值。
【例题6】 将3 ml A和1 ml B混合于一体积可变的密闭容器P中,以此时的温度、压强和体积作为起始条件,发生了如下反应:3A(g)+B(g) 2C(g)+D(g),达到平衡时C的浓度为ω ml·L-1。试回答下列问题:(1)保持温度和压强不变,按下列四种配比充入容器P中,平衡后C的浓度仍为ω ml·L-1的是( )A.6 ml A和2 ml BB.3 ml A+1 ml B+2 ml CC.2 ml C+1 ml B+1 ml DD.1 ml C+2 ml D
(2)保持原起始温度和体积不变,要使平衡后C的浓度仍为ω ml·L-1,应按下列哪种配比向另一容器Q中充入有关物质( )A.3 ml A+1 ml BB.4 ml C+2 ml DC.1.5 ml A+0.5 ml B+1 ml C+0.5 ml DD.无法判断(3)保持原起始温度和体积不变,若仍按3 ml A和1 ml B 配比在容器Q中发生反应,则平衡时C的浓度和ω ml·L-1的关系是( )A.大于ωB.小于ωC.等于ωD.不能确定
人教版 (新课标)选修1 化学与生活第四章 保护生存环境综合与测试多媒体教学课件ppt: 这是一份人教版 (新课标)选修1 化学与生活第四章 保护生存环境综合与测试多媒体教学课件ppt,共16页。PPT课件主要包含了专题1,专题2,专题3等内容,欢迎下载使用。
化学选修1 化学与生活第二章 促进身心健康综合与测试授课课件ppt: 这是一份化学选修1 化学与生活第二章 促进身心健康综合与测试授课课件ppt,共15页。PPT课件主要包含了专题1,专题2,专题3等内容,欢迎下载使用。
高中化学人教版 (新课标)选修4 化学反应原理第四章 电化学基础综合与测试图片课件ppt: 这是一份高中化学人教版 (新课标)选修4 化学反应原理第四章 电化学基础综合与测试图片课件ppt,共21页。PPT课件主要包含了专题1,专题2,专题3,专题4,专题5,原电池的工作原理,电解池的工作原理等内容,欢迎下载使用。













