
人教版 (2019)第六章 化学反应与能量第一节 化学反应与能量变化优秀学案设计
展开化学反应与能量变化(2)
重难点 | 题型 | 分值 | |
重点 | 1. 化学能与电能的转化关系。 2. 知道原电池是利用氧化还原反应将化学能转化为电能的装置,掌握原电池的原理以及构成条件,以及判断原电池的正、负极。 3. 设计原电池 4. 会正确书写电极反应式,熟知原电池的应用。 | 选择与填空 | 8-12分 |
难点 | 1. 判断原电池的正、负极。 2. 正确书写电极反应式 3. 原电池的应用。 | ||
核心知识点一:
一、原电池
1. 原电池的工作原理
(1)原电池概念:将化学能转变为电能的装置。
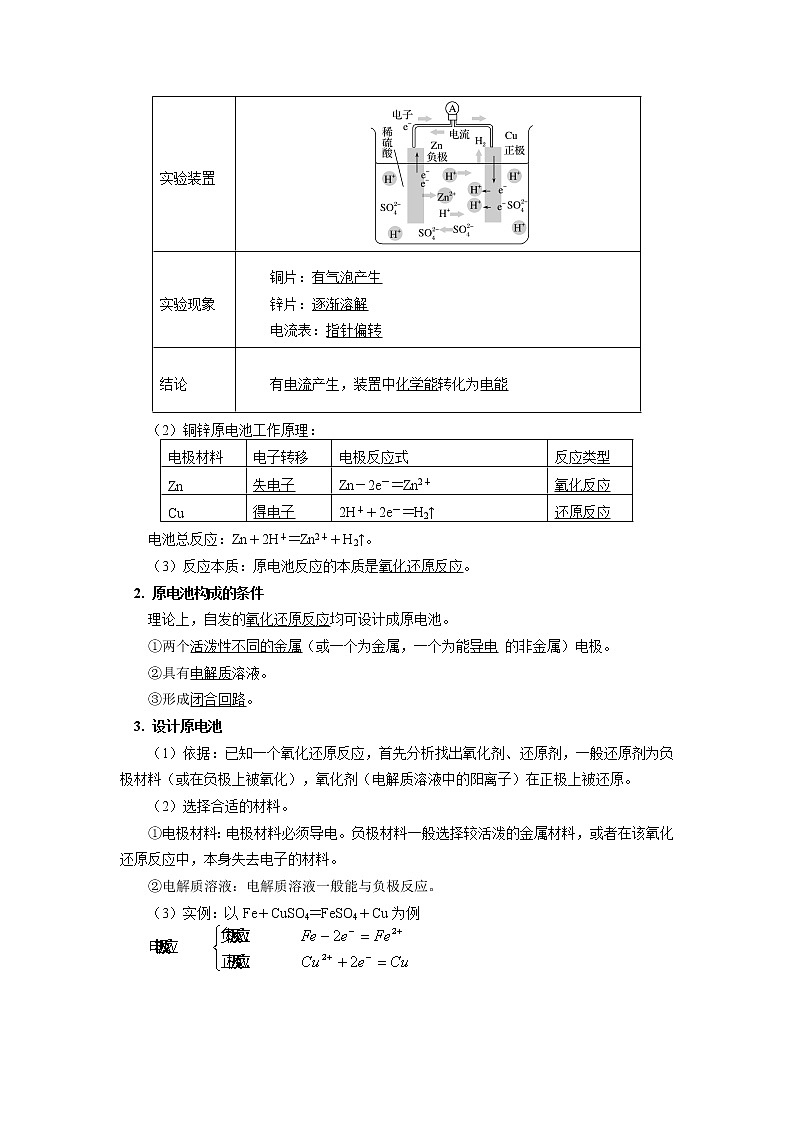
实验装置 | |
实验现象 | 铜片:有气泡产生 锌片:逐渐溶解 电流表:指针偏转 |
结论 | 有电流产生,装置中化学能转化为电能 |
(2)铜锌原电池工作原理:
电极材料 | 电子转移 | 电极反应式 | 反应类型 |
Zn | 失电子 | Zn-2e-=Zn2+ | 氧化反应 |
Cu | 得电子 | 2H++2e-=H2↑ | 还原反应 |
电池总反应:Zn+2H+=Zn2++H2↑。
(3)反应本质:原电池反应的本质是氧化还原反应。
2. 原电池构成的条件
理论上,自发的氧化还原反应均可设计成原电池。
①两个活泼性不同的金属(或一个为金属,一个为能导电 的非金属)电极。
②具有电解质溶液。
③形成闭合回路。
3. 设计原电池
(1)依据:已知一个氧化还原反应,首先分析找出氧化剂、还原剂,一般还原剂为负极材料(或在负极上被氧化),氧化剂(电解质溶液中的阳离子)在正极上被还原。
(2)选择合适的材料。
①电极材料:电极材料必须导电。负极材料一般选择较活泼的金属材料,或者在该氧化还原反应中,本身失去电子的材料。
②电解质溶液:电解质溶液一般能与负极反应。
(3)实例:以Fe+CuSO4=FeSO4+Cu为例
装置图
4. 原电池正负极的判断方法
(1)据组成原电池的两极材料判断:一般活泼性较强的金属为负极,活泼性较弱的金属或能导电的非金属为正极。
(2)据电流方向或电子流动方向判断:电流是由正极流向负极,而电子流动方向是由负极流向正极。
(3)据原电池内部电解质溶液中离子的定向移动方向判断:在原电池的电解质溶液中,阳离子向正极移动,阴离子向负极移动。
(4)据原电池两极发生的变化判断:原电池的负极总是失电子发生氧化反应,相应元素化合价升高,而正极总是得电子发生还原反应,相应元素化合价降低。
(5)据反应现象判断:溶解的一极为负极,增重或者有气泡放出的一极为正极。
核心知识点二:
1. 电极反应式的书写
(1)电极反应式书写的一般步骤
列物质,标得失;
看环境,配守恒;
两式相加,验总式。
举例:硫酸作电解质
负极反应式为:2H2-4e-=4H+;正极反应式为:O2 + 4H+ +4eˉ= 2H2O;
总反应式:2H2+O2=2H2O
(2)已知总反应式,书写电极反应式
①写出电极反应式,标出电子转移的方向和数目。
②找出正、负极,失电子的电极为负极;确定溶液的酸、碱性。
③书写电极反应式
(3)书写技巧
若某电极反应式较难写出,可以先写出较易写出的电极反应式,用总反应式减去易写出的电极反应式。如二甲醚(CH3OCH3)酸性燃料电池:
总反应式:CH3OCH3 +3O2 = 2CO2 + 3H2O;
正极的电极反应式: 3O2 +12H+ + 12e- = 6H2O;
负极的电极反应式:CH3OCH3 +3 H2O -12e- = 2CO2 + 12H+
2. 原电池原理的应用
(1)加快氧化还原反应的速率
原理:原电池中,氧化反应和还原反应分别在两极进行,使溶液中离子运动时相互的干扰减小,使反应速率增大。
实例:实验室用Zn和稀硫酸反应制取氢气时,可滴入几滴硫酸铜溶液,形成原电池,加快反应速率。
(2)比较金属活泼性强弱
原理:一般原电池中,活泼金属作负极,发生氧化反应,不活泼金属作正极,发生还原反应。
实例:有两种金属A和B,用导线连接后插入稀硫酸中,观察到A极溶解,B极上有气泡产生。由原电池原理可知,金属活动性:A>B。
(3)设计原电池
以自发的氧化还原反应为基础,设计原电池。
核心知识点一:
下列各组电极材料和电解质溶液中,不能组成原电池的是( )
A. 铜片、石墨棒、稀硫酸
B. 铜片、石墨棒、硝酸银溶液
C. 锌片、铜片、稀盐酸
D. 铜片、铁片、FeCl3溶液
【答案】A
【解析】原电池的电极材料是活泼性不同的金属或能导电的非金属,同时负极金属要与电解质溶液能发生自发的氧化还原反应,A项中铜与稀硫酸不发生反应,故选A。
某科学探究小组为探究电化学原理,设计了如图所示的装置进行探究实验。下列对实验中观察到的现象或相关结论的叙述错误的是( )
A. a和b不连接时,该装置不能形成原电池,铁片上有红色的铜析出
B. a和b用导线连接时,铜片为负极,发生的反应为Cu2++2e-=Cu
C. 无论a和b是否连接,铁片均会被氧化,溶液中均有Fe2+生成
D. a和b用导线连接时,溶液中的Cu2+向铜电极移动
【答案】B
【解析】a和b不连接时,没有形成闭合回路,没有构成原电池,发生化学反应,铁把铜置换出来,A项正确;导线连接后,构成原电池,铁比铜活泼,铁作负极,发生的反应为Fe-2e-=Fe2+,B项错误;根据选项A、B分析可知,无论a和b是否连接,铁片均会被氧化,溶液中均有Fe2+生成,C项正确;构成原电池时,阳离子向正极移动,铜作正极,D项正确。
核心知识点二
1. X、Y、Z都是金属,把X浸入Z的硝酸盐溶液中,X的表面有Z析出,X和Y组成原电池时,Y为电池的负极。X、Y、Z三种金属的活动性顺序为( )
A. X>Y>Z
B. X>Z>Y
C. Y>X>Z
D. Y>Z>X
【答案】C
【解析】根据原电池原理,负极的金属比正极活泼,可知Y>X,根据金属活动性顺序和置换反应原理,可知X>Z,故有Y>X>Z。
2. Mg-AgCl电池是一种能被海水激活的一次性贮备电池,电池反应方程式为2AgCl+Mg=Mg2++2Ag+2Cl-。有关该电池的说法正确的是( )
A. Mg为电池的正极
B. 负极反应为AgCl+e-=Ag+Cl-
C. 不能被KCl溶液激活
D. 可用于海上应急照明供电
【答案】D
【解析】Mg失去电子发生氧化反应,是电池的负极,A项错误;负极反应为Mg-2e-=Mg2+,B项错误;Mg-AgCl电池能够被海水激活,改用KCl作电解质溶液也能够激活该电池,C项错误;Mg-AgCl电池可将化学能转化为电能用于海上应急照明供电,D项正确。
3. 科学家利用下图装置成功实现了由CO2和H2O合成CH4,下列叙述错误的是( )
A. 该装置中GaN电极为负极
B. 铜电极的电极反应式为:CO2 + 8e- + 8H+ = CH4 + 2H2O
C. 电池内H+透过质子交换膜从右向左移动
D. 为提高该系统的工作效率,可向装置中加入稀硫酸
【答案】C
【解析】由装置图中电子流向可知GaN电极为负极,A项正确;电子流入的电极是正极,所以Cu是正极,Cu电极上二氧化碳得电子生成甲烷,CO2+e-=CH4+2H2O,B正确,电池内H+向正极移动,即H+透过质子交换膜从左向右移动,C项错误,向装置中加入少量稀硫酸可以增强导电能力,提供该系统的工作效率,D项正确。
(答题时间:25分钟)
一、选择题:
1. 下列有关电池叙述正确的是( )
A. 水果电池是高效环保的家用电池
B. 锌锰干电池是一种常用的二次电池
C. 锌锰干电池碳棒是负极,锌片是正极
D. 锌锰干电池工作一段时间后锌外壳逐渐变薄
2. 下列说法正确的是( )
A. 镍氢电池、锂电池和碱性锌锰干电池都是二次电池
B. 燃料电池是一种高效但是会污染环境的新型电池
C. 化学电池的反应基础是氧化还原反应
D. 铅蓄电池放电的时候正极材料是Pb,负极材料是PbO2
3. 有关原电池的下列说法中正确的是( )
A. 在外电路中电子由正极流向负极
B. 在原电池中负极发生还原反应
C. 原电池工作时,阳离子向正极方向移动
D. 原电池中正极一定是不活泼金属
4. 有a、b、c、d四个金属电极,有关的实验装置及部分实验现象如下:
实验 装置 | ||||
部分实 验现象 | a极质量减小,b极质量增大 | b极有气体产生,c极无变化 | d极溶解,c极有气体产生 | 电流从a极流向d极 |
由此可判断这四种金属的活动性顺序是( )
A. a>b>c>d B. b>c>d>a
C. d>a>b>c D. a>b>d>c
5. 已知四种金属A、B、C、D,根据下列事实:①A+B2+=A2++B;②D+2H2O=D(OH)2+H2↑;③以B、E为电极与E的盐溶液组成原电池,电极反应为E2++2e-=E,B-2e-=B2+,由此可知,A2+、B2+、D2+、E2+的氧化性强弱关系是( )
A. D2+>A2+>B2+>E2+
B. A2+>B2+>D2+>E2+
C. D2+>E2+>A2+>B2+
D. E2+>B2+>A2+>D2+
6. 锌、稀硫酸和铜组成的原电池装置中,当导线中有1 mol电子通过时,理论上两极的变化是( )
①锌片溶解32. 5 g;②锌片增重32. 5 g;③铜片上析出1 g H2;④铜片上析出1 mol H2
A. ①③ B. ①④
C. ②③ D. ②④
二、填空题
7. 理论上讲,任何自发的氧化还原反应都可以设计成原电池。请利用反应“Cu+2Ag+=2Ag +Cu2+”设计一个化学电池(正极材料用石墨棒)回答下列问题:
(1)该电池的负极材料是________,发生________(填“氧化”或“还原”)反应,电解质溶液是______________________;
(2)正极上出现的现象是 _________________________________________;
(3)若导线上转移电子1 mol,则生成银____g。
8. 微型纽扣电池在现代生活中有广泛应用,有一种银锌电池,其电极分别是Ag2O和Zn,电解质溶液为KOH溶液,电极反应为Zn+2OH--2e-=ZnO+H2O,Ag2O+H2O+2e-=2Ag+2OH-,总反应为Ag2O+Zn=ZnO+2Ag。根据反应式回答问题:
(1)Zn是________极,Ag2O发生________反应。
(2)电子由________极流向________极(填“Zn”或“Ag2O”),当通过电路1 mol电子时,负极消耗物质的质量是________g。
(3)在使用过程中,电解质溶液中KOH的物质的量________(填“增大”“减小”或“不变”)。
1.【答案】D
【解析】水果电池产生的电流非常微弱,不能作为家用电池,A错误;锌锰干电池是一种常用的一次电池,其中锌作负极,碳棒作正极,锌锰干电池工作时,Zn放电消耗,故工作一段时间后锌外壳会逐渐变薄,故B、C错误,D正确。
2.【答案】C
【解析】碱性锌锰干电池是一次电池;燃料电池是一种高效且不会污染环境的新型电池;铅蓄电池放电的时候正极材料是PbO2,负极材料是Pb。
3.【答案】C
【解析】在原电池中,电子从负极流向正极;原电池中负极发生氧化反应;随着反应的进行,阳离子在正极被还原,所以电解质溶液中的阳离子向正极移动;原电池中一般正极金属比负极金属活泼性差,但不一定是不活泼金属,故选C。
4. 【答案】C
【解析】装置一是原电池,a极质量减小,说明a极金属易失去电子形成离子,故a极金属比b极金属活泼;装置二没有形成原电池,可知b比c活泼,且c位于金属活动性顺序表中氢的后面;装置三和四均形成原电池,易知d比c活泼,d比a活泼。因此四种金属的活动性顺序为d>a>b>c,故选C。
5.【答案】D
【解析】由①知,A比B活泼;由②知,D的活泼性较强,能置换出H2O中的氢,故D的活泼性大于A;由③知,B作负极,活泼性大于E,则金属的活动性顺序是D>A>B>E,而金属单质的还原性越弱,其阳离子的氧化性越强,故D正确。
6.【答案】A
【解析】由电池总反应Zn+2H+=Zn2++H2↑、正极反应2H++2e-=H2↑、负极反应Zn-2e-=Zn2+可知,每当1 mol电子通过铜片时,会有0. 5 mol(即32. 5 g)锌溶解,铜片上析出0. 5 mol(即1 g)H2。
7.【答案】(1)Cu 氧化 AgNO3溶液
(2)石墨棒上出现银白色物质
(3)108
【解析】在Cu+2Ag+=2Ag +Cu2+中,Cu作还原剂,应作原电池的负极,失去电子,发生氧化反应;Ag+作氧化剂,在原电池的正极得电子,故石墨棒上有银白色物质析出,且每转移1 mol电子,则生成银108 g;电解质是含Ag+的可溶性盐,通常是AgNO3溶液。
8.【答案】(1)负 还原 (2)Zn Ag2O 32. 5 (3)不变
【解析】(1)根据电极反应可知Zn失电子被氧化而溶解,Ag2O得电子被还原发生还原反应。(2)发生原电池反应时,电子由负极经外电路到正极,即电子从Zn极经外电路到Ag2O极,当通过电路1 mol电子时,负极消耗Zn的质量是32. 5 g。(3)电池中KOH只起到增强导电的作用,不参与反应,故电池使用过程中KOH的量不变。
人教版 (2019)第一节 化学反应与能量变化第2课时导学案: 这是一份人教版 (2019)第一节 化学反应与能量变化第2课时导学案,共11页。学案主要包含了化学能转化为电能等内容,欢迎下载使用。
高中人教版 (2019)第一节 化学反应与能量变化第1课时导学案: 这是一份高中人教版 (2019)第一节 化学反应与能量变化第1课时导学案,共12页。学案主要包含了化学反应与能量,人类对能源的利用等内容,欢迎下载使用。
2021学年第一节 化学反应与能量变化学案: 这是一份2021学年第一节 化学反应与能量变化学案,共11页。学案主要包含了学习目标,学习重难点,学习过程,知识回顾,探究实验一,探究实验二,目标检测,参考答案等内容,欢迎下载使用。