



人教版 (新课标)选修35 热力学第二定律的微观解释授课ppt课件
展开热力学第二定律指出,一切与热现象有关的宏观自然过程都是不可逆的。在一定条件下,系统有从非平衡态过渡到平衡态的自然倾向,这种倾向总是单向不可逆的。从微观上看,过程的不可逆性与系统的大量分子的无规则运动是分不开的。今以气体向真空的自由膨胀为例,用微观的统计平均方法 ,从本质上说明热力学第二定律的统计意义。
1.有序和无序 有序:只要确定了某种规则,符合这个规则的 就叫做有序。 无序:不符合某种确定规则的称为无序。 无序意味着各处都一样,平均、没有差别,有序则相反。有序和无序是相对的。
有序和无序 宏观态和微观态
2.宏观态和微观态宏观态:符合某种规定、规则的状态,叫做热 力学系统的宏观态。微观态:在宏观状态下,符合另外的规定、规 则的状态叫做这个宏观态的微观态
系统的宏观态所对应的微观态的多少表现为宏观态无序程度的大小。如果一个“宏观态”对应的“微观态”比较多,就说这个“宏观态”是比较无序的.
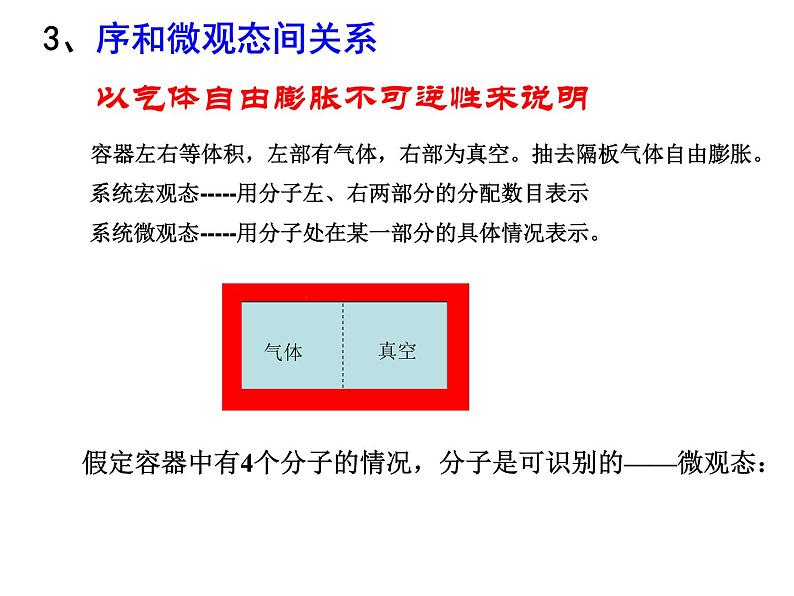
以气体自由膨胀不可逆性来说明
容器左右等体积,左部有气体,右部为真空。抽去隔板气体自由膨胀。 系统宏观态-----用分子左、右两部分的分配数目表示 系统微观态-----用分子处在某一部分的具体情况表示。
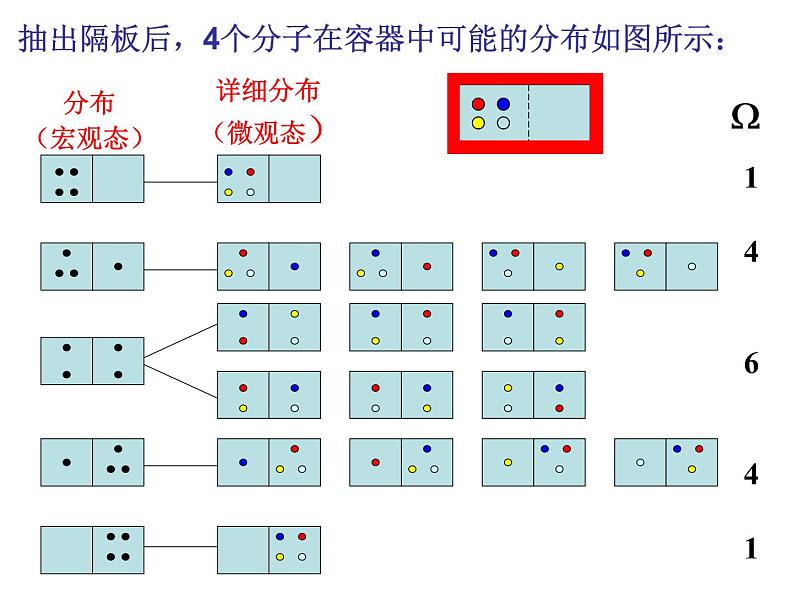
假定容器中有4个分子的情况,分子是可识别的——微观态:
分布(宏观态)
详细分布(微观态)
抽出隔板后,4个分子在容器中可能的分布如图所示:
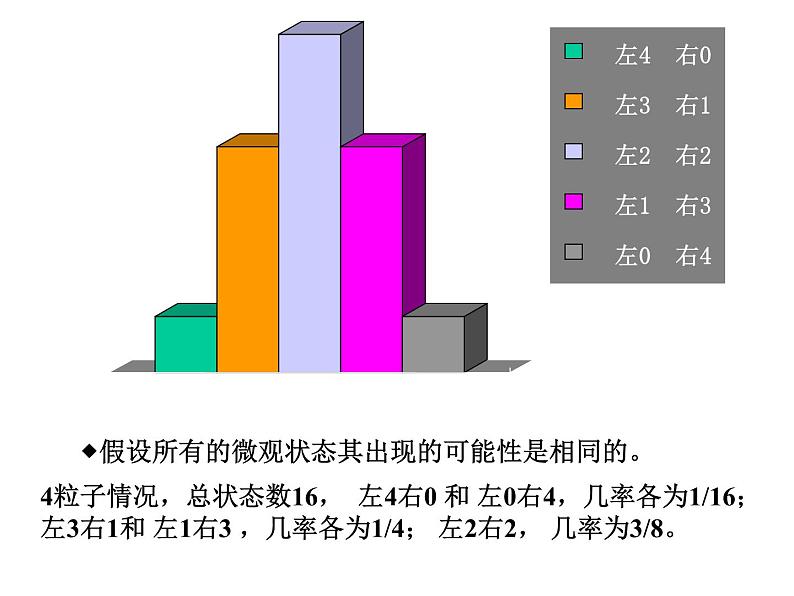
假设所有的微观状态其出现的可能性是相同的。
4粒子情况,总状态数16, 左4右0 和 左0右4,几率各为1/16;左3右1和 左1右3 ,几率各为1/4; 左2右2, 几率为3/8。
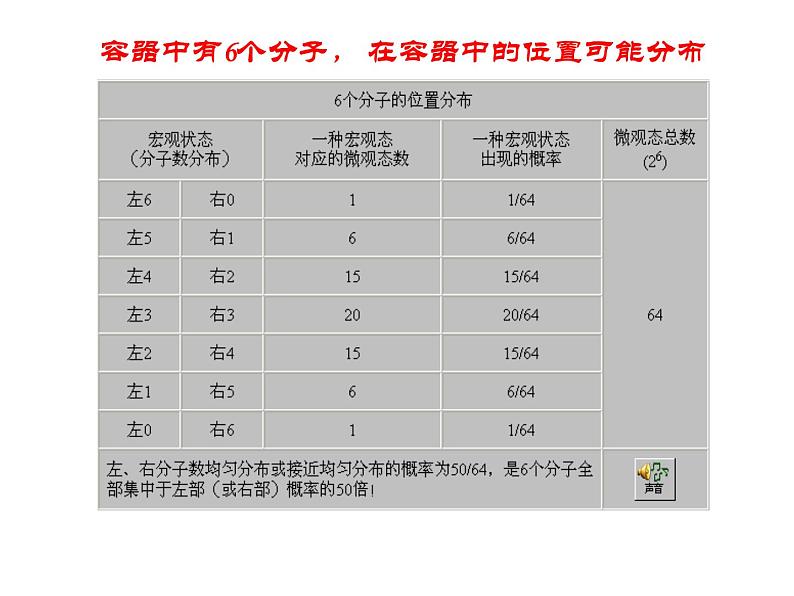
容器中有6个分子, 在容器中的位置可能分布
统计物理基本假定—等几率原理:对于孤立系,各种微观态出现的可能性(或几率)是相等的。
各种宏观态不是等几率的。那种宏观态包含的微观态数多,这种宏观态出现的可能性就大。
定义热力学几率:与同一宏观态相应的微观态数称为热力学几率。记为 。
在上例中,均匀分布这种宏观态,相应的微观态最多,热力学几率最大,实际观测到的可能性或几率最大。
所以,实际观测到的总是均匀分布这种宏观态。即系统最后所达到的平衡态。
对于1023个分子组成的宏观系统来说,均匀分布这种宏观态的热力学几率与各种可能的宏观态的热力学几率的总和相比,此比值几乎或实际上为100%。
平衡态相应于一定宏观条件下 最大的状态。
热力学第二定律的统计表述:孤立系统内部所发生的过程总是从包含微观态数少的宏观态向包含微观态数多的宏观态过渡,从热力学几率小的状态向热力学几率大的状态过渡。
自然过程总是向着使系统热力学几率增大的方向进行。
4.热力学第二定律的适用范围
注意:微观状态数最大的平衡态状态是最混乱、最无序的状态。
一切自然过程总是沿着无序性增大的方向进行。
1)适用于宏观过程对微观过程不适用,
2)孤立系统有限范围,
为了研究的方便,玻耳兹曼用一个新的状态函数——熵 S来表示系统无序性的大小。定义熵与热力学概率之间的关系为: S=kln 其中k为玻耳兹曼常量,上式称为玻耳兹曼关系式或玻耳兹曼熵公式。
用熵 S 代替热力学概率后,热力学第二定律可以表述为:在孤立系统中进行的自发过程总是沿着熵增加的方向进行,它是不可逆的,平衡态相应于熵最大值的状态。热力学第二定律的这一表述称为熵增加原理。
熵的微观意义:系统内分子热运动无序性的量度。
高中物理人教版 (新课标)选修35 热力学第二定律的微观解释备课ppt课件: 这是一份高中物理人教版 (新课标)选修35 热力学第二定律的微观解释备课ppt课件
物理选修35 热力学第二定律的微观解释示范课课件ppt: 这是一份物理选修35 热力学第二定律的微观解释示范课课件ppt
高中物理人教版 (新课标)选修35 热力学第二定律的微观解释备课课件ppt: 这是一份高中物理人教版 (新课标)选修35 热力学第二定律的微观解释备课课件ppt













