





2021年人教版九年级化学中考知识点复习: 溶液 教学课件PPT
展开1.溶液是均一、稳定的混合物,所以均一、稳定的物质就是溶液。( )2.一种溶液中的溶质只能有一种,溶剂可以不止一种。( )3.一定温度下,氯化钠的饱和溶液不能再溶解硝酸钾。( )4.析出晶体后的溶液一定是该物质在该温度下的饱和溶液。( )5.饱和溶液降温一定能析出晶体。( )6.饱和溶液一定是浓溶液,不饱和溶液一定是稀溶液。( )
7.饱和溶液一定比不饱和溶液浓。( )8.洗涤剂除油污的原理是乳化,所以氢氧化钠除油污的原理也是乳化。( )9.30 ℃时,A物质的饱和溶液中溶质的质量分数为20%,则其溶解度为20 g。( )
有关溶解度的坐标图像分析
一、常规溶解度曲线分析1.判断溶解度随温度的变化趋势(1)上升型曲线,溶解度随温度的升高而增大。(2)下降型曲线,溶解度随温度的升高而减小。(3)曲线越陡,物质的溶解度受温度变化的影响越大。
2.判断与比较溶解度的大小(1)某温度下物质的溶解度:该温度下对应点的纵坐标的值,单位为“g”。(2)比较同一温度下几种物质溶解度的大小,曲线上的点距离横轴的垂直距离越大,溶解度越大。
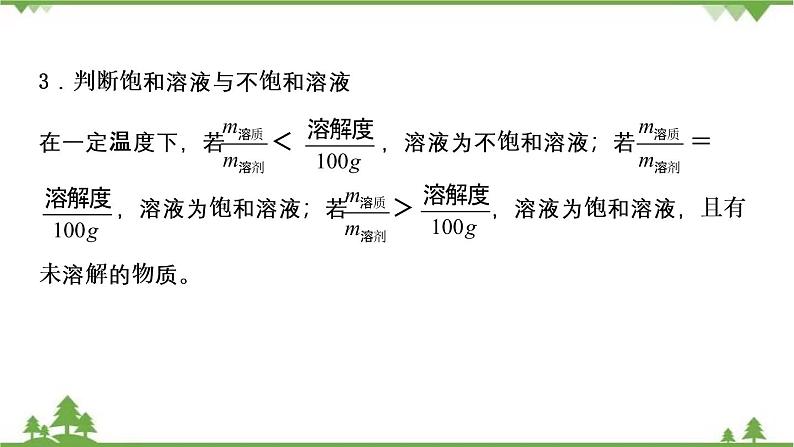
3.判断饱和溶液与不饱和溶液在一定温度下,若 < ,溶液为不饱和溶液;若 = ,溶液为饱和溶液;若 > ,溶液为饱和溶液,且有未溶解的物质。
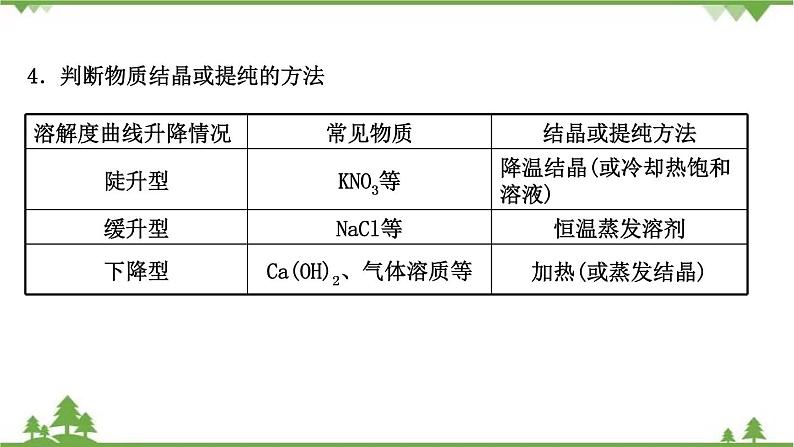
4.判断物质结晶或提纯的方法
5.溶质质量分数的判断和比较首先判断溶液状态,若为饱和溶液,则溶质质量分数为 ×100%,即溶解度相等,溶质质量分数相等;若为不饱和溶液,则溶质质量分数为 ×100%。
【注意】(1)温度和溶液的状态不能确定时,无法比较不同物质的溶质质量分数大小。(2)向一定量的溶剂中加入一定量的固体,若固体未全部溶解,则不能用 ×100%计算溶液的溶质质量分数,可用 ×100%进行计算。
二、 溶解度曲线与溶解度表格结合解答此类题首先需要结合表格所给信息判断溶解度随温度变化情况,然后应用常规溶解度曲线方法进行解题。三、溶解度曲线与实物图结合解答此类题首先需要结合实物图确定溶液是否饱和,其中若有固体析出、剩余或溶液浑浊则说明溶液已饱和,同时注意溶液质量不一定等于容器内各物质总质量。
四、其他有关溶解度的图像分析纵坐标为溶液质量或剩余固体质量时的解题方法如下:1.判断饱和溶液与不饱和溶液若要判断溶液的情况,需首先理解“饱和溶液”的含义,即在温度、溶剂质量一定情况下,“饱和溶液”为不能继续溶解该溶质的溶液,故在该状态下,该溶液的质量不再增大、剩余固体的质量不再减小,据此进行分析解答。
2.溶解度计算计算溶解度首先要确定曲线什么时候为饱和状态,再根据溶解度的定义(100g溶剂中达到饱和状态时所溶解的溶质质量)进行解答。
A、B、C三种固体物质的溶解度曲线如图所示。(1)A物质的溶解度随温度的升高而________(填“增大”或“减小”)。(2)t1 ℃时,A、B两物质的溶解度相等,均为_______;t2 ℃时,A、B、C三种物质的溶解度大小关系为__________。(3)t2 ℃时,将等质量的A、B、C三种物质的饱和溶液降温到t1 ℃,此时,溶液中析出晶体质量关系是__________。
1.(2019·重庆A)甲、乙的溶解度曲线如图所示(不考虑水的变化)。下列说法正确的是( )
A.依据溶解度曲线可判断,甲的溶解度比乙的大B.t2 ℃时,甲的饱和溶液中溶质质量分数为40%C.t2 ℃时,将甲、乙饱和溶液分别降温至t1 ℃,析出晶体甲的质量大D.t1 ℃时,将甲、乙饱和溶液分别升温至t2 ℃,两溶液中溶质质量分数相等
2.(2020·重庆育才中学模拟)A、B、C的溶解度曲线如图所示(不考虑水的变化)。下列说法正确的是( )
A.t1 ℃时,A的溶解度为70B.t0 ℃时,C的饱和溶液溶质质量分数为60%C.A中含有少量的B,可以用冷却热饱和溶液的方法提纯AD.t2 ℃时,将A、B、C的饱和溶液降温至t1 ℃,析出晶体A的质量最多
3.(2020·重庆一中定时作业)溶液与生产生活密切相关,图Ⅰ为三种固体物质的溶解度曲线,图Ⅱ为实验操作。
(1)t1 ℃时,向盛有15 g丙物质的烧杯中加入_____g水充分溶解,恰好得饱和溶液。(2)某同学按照图Ⅱ所示进行实验操作,所得的A、B、C三种状态的溶液,其中属于不饱和溶液的是_____(填序号)。(3)t3 ℃时三种物质的饱和溶液分别恒温蒸发等量水,析出固体质量由大到小为_____________;过滤后将溶液降温到t2 ℃,三种溶液的溶质质量分数由大到小为_____________。
4.(2020·重庆B)氯化钠、碳酸钠、硝酸钾在不同温度时的溶解度如下表所示,某同学根据表中数据作出了其中一种物质的溶解度曲线(如下图所示),请根据表和图中信息填空。
(1)曲线M是表中__________________的溶解度曲线,该物质在5 ℃时的溶解度约为_____g。(2)如果将表中三种物质的溶解度曲线全部画出,在0 ℃ ~40 ℃范围内会有____个两线交点。(3)10 ℃时,将15 g氯化钠和15 g硝酸钾固体同时加入盛有50 g水的烧杯中,充分搅拌、溶解、静置后,烧杯底部剩余的固体是________________。
碳酸钠(或Na2CO3)
5.(2020·重庆西大附中模拟)在不同温度下,向盛有50 g水的烧杯中缓慢加入固体M,测得溶液质量与加入溶质M质量的变化关系如图,试回答下列问题。
(1)由图可知,随着温度升高,溶质M的溶解度_______(填“增大”“减小”或“不变”)。(2)20 ℃时,A、B、C三点溶液属于饱和溶液的是____(填字母)。(3)30 ℃时,D点溶液溶质的质量分数为________(精确到0.1%)。(4)30 ℃时,将D点溶液转化为不饱和溶液的方法有_____(填序号)。①升温至40 ℃以上②向溶液中再加25 g水③降低温度至20 ℃以下
6.(2020·武汉)将30 g固体物质X(不含结晶水)投入盛有20 g水的烧杯中,搅拌,测得0 ℃、t1 ℃、t2 ℃、t3 ℃时烧杯中溶液质量分别如图中A、B、C、D点所示。
人教版中考化学复习第九单元溶液教学课件: 这是一份人教版中考化学复习第九单元溶液教学课件,共39页。PPT课件主要包含了混合物,被溶解,几乎不溶解,溶解性是不同的,不同的,NH4NO3,NaOH,NaCl,乳化作用,托盘天平等内容,欢迎下载使用。
人教版中考化学复习第九单元溶液教学课件: 这是一份人教版中考化学复习第九单元溶液教学课件,共39页。PPT课件主要包含了混合物,被溶解,几乎不溶解,溶解性是不同的,不同的,NH4NO3,NaOH,NaCl,乳化作用,托盘天平等内容,欢迎下载使用。
中考化学复习主题四常见的溶液教学课件: 这是一份中考化学复习主题四常见的溶液教学课件,共30页。PPT课件主要包含了几乎不溶解,溶解性是不同的,1固体的溶解度,托盘天平,玻璃棒,不放纸片,②①⑤③④等内容,欢迎下载使用。












