



初中化学人教版九年级下册第八单元 金属和金属材料课题 2 金属的化学性质评课课件ppt
展开【重点】认识金属活动性顺序。
【难点】利用金属活动性顺序解释日常生活中的化学问题。
1.通过常见金属与某些金属化合物溶液的置换反应认识金属的化学性质及其活动性顺序;2.能用金属活动性顺序对有关的置换反应进行简单的判断;3.利用金属活动性顺序解释一些日常生活中的化学问题。
1.判断金属活动性的方法一:根据金属与氧气反应的难易或剧烈程度
2.判断金属活动性的方法二:根据金属与酸能否反应或反应的剧烈程度
知识点1、金属与金属化合物溶液的反应
金属与金属化合物溶液的反应
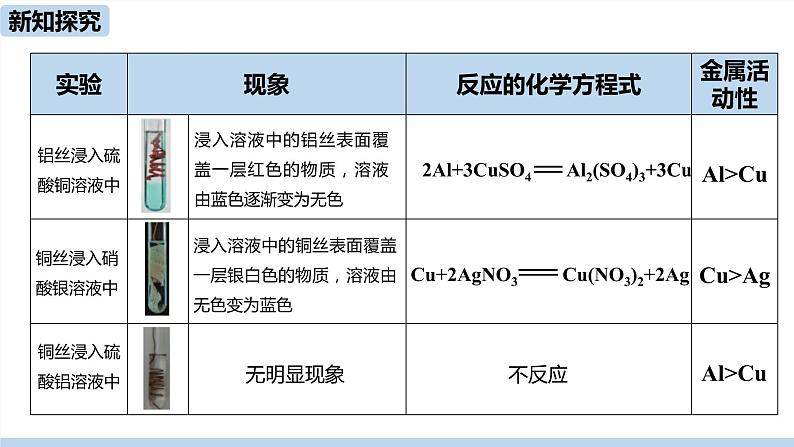
浸入溶液中的铝丝表面覆盖一层红色的物质,溶液由蓝色逐渐变为无色
2Al+3CuSO4 Al2(SO4)3+3Cu
浸入溶液中的铜丝表面覆盖一层银白色的物质,溶液由无色变为蓝色
Cu+2AgNO3 Cu(NO3)2+2Ag
1.实验前用砂纸将金属丝表面打磨光亮,以免表面的氧化膜影响实验。2.描述反应现象时要注意:一是置换出的金属附着在原金属的表面,二是要注意溶液颜色的变化。3.铁与金属化合物溶液发生置换反应时,生成物中铁元素呈+2价。
铝能置换出硫酸铜溶液中的铜,铜能置换出硝酸银溶液中的银,铜不能从硫酸铝溶液中置换出铝。Al、Cu、Ag的活动性由强到弱的顺序为Al>Cu>Ag。
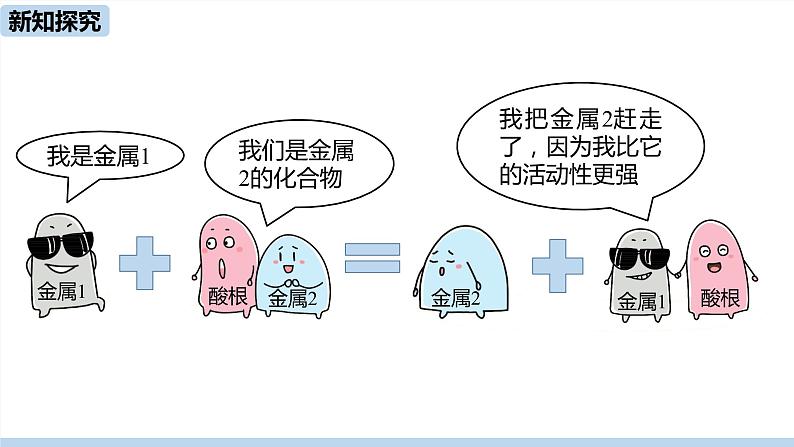
我把金属2赶走了,因为我比它的活动性更强
判断金属活动性的方法三: 可根据金属能不能把另一种金属从其金属化合物溶液中置换出来,判断金属活动性的强弱。
(2019·郴州中考)把一枚无锈铁钉放在硫酸铜溶液中,一段时间后,可出现的是( )
A.溶液蓝色变浅直至无色B.铁钉表面析出红色物质C.产生大量气泡D.溶液质量增加
解析:铁能与硫酸铜溶液反应生成硫酸亚铁溶液和铜,溶液蓝色变浅直至浅绿色,铁钉表面析出红色物质;该反应无气泡产生;Fe+CuSO₄ FeSO₄+Cu,该反应每56份质量的铁可置换出64份质量的铜,溶液的质量会减少。
知识点2、金属活动性顺序
判断金属活动性强弱的方法有很多种,常根据金属能否与酸发生置换反应、与酸反应的剧烈程度、能否与金属化合物溶液反应来判断金属的活动性强弱。
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
金属活动性由强逐渐减弱
K、Ca、Na、Mg、Al (见个大美女)Zn、Fe、Sn、Pb、(H) (身体细纤轻)Cu、Hg、Ag、Pt、Au (统共一百斤)
1.在金属活动性顺序里,金属的位置越靠前,它的活动性就越强。2.在金属活动性顺序里,位于氢前面的金属能置换出酸中的氢。3.在金属活动顺序里,位于前面的金属能把位于后面的金属从它们化合物的溶液中置换出来。
前换后,盐可溶,钾钙钠,要除外
1.金属活动性是指金属原子在溶液中失去电子的能力。2.酸一般指稀硫酸、盐酸等不具有强氧化性的酸。浓硫酸、硝酸因具有强氧化性与金属反应不产生氢气。3.铁与酸或金属化合物溶液发生置换反应时,生成亚铁化合物。4.钾、钙、钠三种金属非常活泼,常温下能和水反应,因此这三种金属不能将位于它们后面的金属从其化合物溶液中置换出来。
金属活动性顺序的探究方法
设计实验方案验证Zn、Cu、Ag三种金属的活动性顺序。
设计方案1:“两单夹一液”。
药品:锌片、银片、CuSO4溶液。操作:将锌片、银片分别放入CuSO4溶液中。判断:根据是否有紫红色固体被置换出来确定金属活动性顺序。
设计方案2:“两液夹一单”。
药品:ZnCl2溶液、AgNO3溶液、铜丝。操作:将铜丝分别放入ZnCl2溶液、AgNO3溶液中。判断:根据是否有金属被置换出来确定金属活动性顺序。
设计方案3:“两单一液和一酸”。
药品:锌片、铜丝、AgNO3溶液、稀盐酸。操作与判断:取锌片、铜丝分别放入稀盐酸中,验证Zn和 Cu的活动性顺序;然后再将铜丝放入AgNO3溶 液中,验证Cu和Ag的活动性顺序。
1.为什么要用不活泼的金属制造货币?
2.根据金属活动性顺序表判断能否用锡壶装醋?
不能,因为锡能跟酸反应。
有X、Y、Z三种金属片,分别放入稀硫酸中,X、Z表面有气泡产生,Y没有明显现象;X放入ZCln溶液中,没有明显现象。判断这三种金属的活动性由强到弱的顺序是 ( )
A.X>Y>Z B.Z>X>YC.X>Z>Y D.Y>X>Z
方法点拨:本题判断金属活动性顺序的方法:(1)根据金属能否与稀硫酸反应放出氢气判断;(2)根据金属与另一种金属化合物溶液能否发生置换反应判断。
2Al+3CuSO4 Al2(SO4)3+3Cu
金属与金属化合物溶液反应
Cu+2AgNO3 Cu(NO3)2+2Ag
1.比较金属的活动性强弱2.判断金属与酸能否发生置换反应3.判断金属和金属化合物溶液能否发生置换反应
1. 下列金属中,金属活动性最强的是( )A.钾 B.铁C.铜 D.金
2.验证镁、铜的金属活动性顺序,下列试剂不能选用的是( )
A.MgSO4溶液 B.KCl溶液C.稀盐酸 D.ZnCl2溶液
解析:镁、铜均不能与KCl溶液反应,据此可知三种金属中钾最活泼,但无法比较镁、铜的活动性强弱。
3.(2019·巴中中考)将铁粉加入到ZnSO4和CuSO4的混合溶液中,充分反应后过滤,向滤渣中滴加稀硫酸,无气泡产生,下列有关分析错误的是( )
A.反应后滤液中一定含有ZnSO4和FeSO4,可能含有CuSO4B.滤渣中的固体只有CuC.反应后的溶液的质量一定减少D.滤渣中的固体一定有Cu,可能含有Fe
解析:将铁粉加入到ZnSO4和CuSO4的混合溶液中,铁只与硫酸铜溶液发生置换反应,生成硫酸亚铁和铜。充分反应后过滤,向滤渣中滴加稀硫酸,无气泡产生,证明滤渣中的固体不含铁,硫酸铜可能与铁恰好完全反应,也可能有剩余,因此反应后滤液中一定含有ZnSO4和FeSO4,可能含有CuSO4;由于滤渣中的固体不含铁,所以滤渣中的固体只有铜;每56份质量的铁能置换出64份质量的铜,所以溶液质量减少。
初中化学人教版九年级下册课题 2 金属的化学性质获奖ppt课件: 这是一份初中化学人教版九年级下册课题 2 金属的化学性质获奖ppt课件,文件包含82-2金属的化学性质第2课时pptx、82-2教学设计金属的化学性质第2课时docx、82-2练习·能力提升金属的化学性质第2课时docx、82-2练习·素能拓展金属的化学性质第2课时docx、82-2练习·基础巩固金属的化学性质第2课时docx、82-2预习导学金属的化学性质第2课时docx等6份课件配套教学资源,其中PPT共17页, 欢迎下载使用。
人教版九年级下册课题 2 金属的化学性质示范课ppt课件: 这是一份人教版九年级下册课题 2 金属的化学性质示范课ppt课件,共24页。PPT课件主要包含了a比较硬度,b比较密度,一金属与氧气的反应,灼烧法,加入稀硫酸或稀盐酸,FeCu,Al﹥Cu﹥Ag,课本P11探究,置换反应等内容,欢迎下载使用。
2021学年课题 2 金属的化学性质授课课件ppt: 这是一份2021学年课题 2 金属的化学性质授课课件ppt,文件包含822金属活动性顺序pptx、01铁置换铜蓝色海洋中的红珊瑚mp4、02感受金属之美-金属树mp4、03探究实验金属活动顺序mp4等4份课件配套教学资源,其中PPT共14页, 欢迎下载使用。













