
高中化学人教版 (新课标)必修1第二节 几种重要的金属化合物第3课时教学设计及反思
展开三维目标
知识与技能
1.了解FeO、Fe2O3、Fe3O4的性质和应用。
2.掌握Fe2+、Fe3+的检验方法及相互转化。
3.掌握Fe(OH)2、Fe(OH)3的制备和性质。
4.通过演示和学生实验,培养学生的观察能力、动手能力及分析综合能力。
过程与方法
1.利用列表比较的方法,掌握铁的重要化合物的性质。
2.通过实物展示、演示和学生实验相结合的方法,启发、诱导学生突破难点、巩固重点。
情感、态度与价值观
1.结合铁的重要化合物性质的教学,对学生进行辩证唯物主义教育。
2.通过启发、诱导、观察、动手、讨论,提高学生思维能力和灵活分析、解决问题的能力。
教学重点
铁的氧化物、氢氧化物的性质
教学难点
Fe(OH)2的制备,Fe2+、Fe3+的相互转化
教具准备
投影仪、FeCl3溶液、FeSO4溶液、2 ml·L-1 NaOH溶液、氨水、2 ml·L-1盐酸、KSCN溶液、FeO、Fe2O3、Fe3O4、铁粉、氯水、试管、胶头滴管、药匙
教学过程
师:上一课时我们学习了铝的重要化合物,请大家回顾Al2O3和Al(OH)3有哪些重要的化学性质?实验室怎样制备Al(OH)3?为何不用NaOH溶液制备Al(OH)3?
生:Al2O3、Al(OH)3都具有两性,既能与酸反应生成盐和水,也能和碱反应生成盐和水。
实验室常用氨水和铝盐溶液反应制备Al(OH)3;不用NaOH溶液是因为Al(OH)3能被NaOH溶液溶解。
师:铁是过渡元素中的主要代表元素,前面我们了解了铁单质的有关性质,这一节课我们共同学习铁的重要化合物。
[板书] (三)铁的重要化合物
师:大家回顾前面我们学习钠和铝的重要化合物时的学习次序是怎样的?
生:先学习氧化物,再学习氢氧化物,最后学习盐的代表。
师:很好,铁的重要化合物的学习次序与前面是一致的。
[板书]1.铁的氧化物
[投影]铁的氧化物性质比较表,备填(表一)
教师出示铁的三种氧化物让学生观察,并分别验证其溶解性、与酸反应等性质,讲解分析,依次填充表格(也可指名板演)。
[总结] FeO、Fe2O3是碱性氧化物,都能与酸反应生成盐和水,Fe3O4是一种复杂的化合物,可以看作是FeO·Fe2O3,但Fe3O4是纯净物不是混合物。
[板书]2.铁的氢氧化物
师:根据铁元素的常见化合价,铁应该有哪些氢氧化物?
生:有Fe(OH)2和Fe(OH)3。
[投影] 出示铁的氢氧化物性质比较表,备填(表二)
教师边讲解、边演示、边填表(也可以让学生填写)。
师:Fe(OH)2在空气中极易被氧化,实验室中如何采取一定措施制得白色的Fe(OH)2沉淀呢?大家讨论。
生:把胶头滴管插入溶液深处滴加NaOH溶液,因为溶液深处溶解的O2较少;用煮沸的蒸馏水配制FeSO4、NaOH溶液,煮沸可以使溶解的O2被赶出;配好的FeSO4溶液上面滴加少量汽油,隔绝空气,防止FeSO4被氧化。
师:同学们回答得很好,以上都是实验中常采取的措施,还有一些方法可采用,参见随堂练习。
[例题剖析]
(例1)(2007山东东营模拟,22)用下面两种方法可以制得白色的Fe(OH)2沉淀。
方法一:用不含Fe3+的FeSO4溶液与用不含O2的蒸馏水配制的NaOH溶液反应制备。
(1)用硫酸亚铁晶体配制上述FeSO4溶液时还需加入________________________。
(2)除去蒸馏水中溶解的O2常采用____________的方法。
(3)生成白色Fe(OH)2沉淀的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液。这样操作的理由是________________________。
方法二:在如右图装置中,用NaOH溶液、铁屑、稀H2SO4等试剂制备。
(1)在试管Ⅰ里加入的试剂是_____________________。
(2)在试管Ⅱ里加入的试剂是_____________________。
(3)为了制得白色Fe(OH)2沉淀,在试管Ⅰ和Ⅱ中加入试剂,打开止水夹,塞紧塞子后的实验步骤是__________________________________________。
(4)这样生成的Fe(OH)2沉淀能较长时间保持白色,其理由是_________________________。
解析:首先要抓住氢氧化亚铁的性质,即易氧化,遇氧气迅速生成氢氧化铁。方法一是教材中的方法,为防止氧化,胶头滴管反常规操作,或在溶液中加入还原性物质如铁粉。
方法二将原来的方法进行了改进,去掉了原有的胶头滴管,创设了新情景,要求学生在已经掌握制备氢氧化亚铁的实验操作及实验原理的基础上,说明方法二制备氢氧化亚铁的原理,同时也考查了对启普发生器的原理的理解。
答案:方法一:(1)稀H2SO4、铁屑
(2)煮沸
(3)避免生成的Fe(OH)2沉淀接触O2
方法二:(1)稀H2SO4、铁屑
(2)NaOH溶液
(3)检验试管Ⅱ出口处排出的氢气的纯度。当排出的H2纯净时,再夹紧止水夹
(4)试管Ⅰ中反应生成的H2充满了试管Ⅰ和试管Ⅱ,外界空气不容易进入
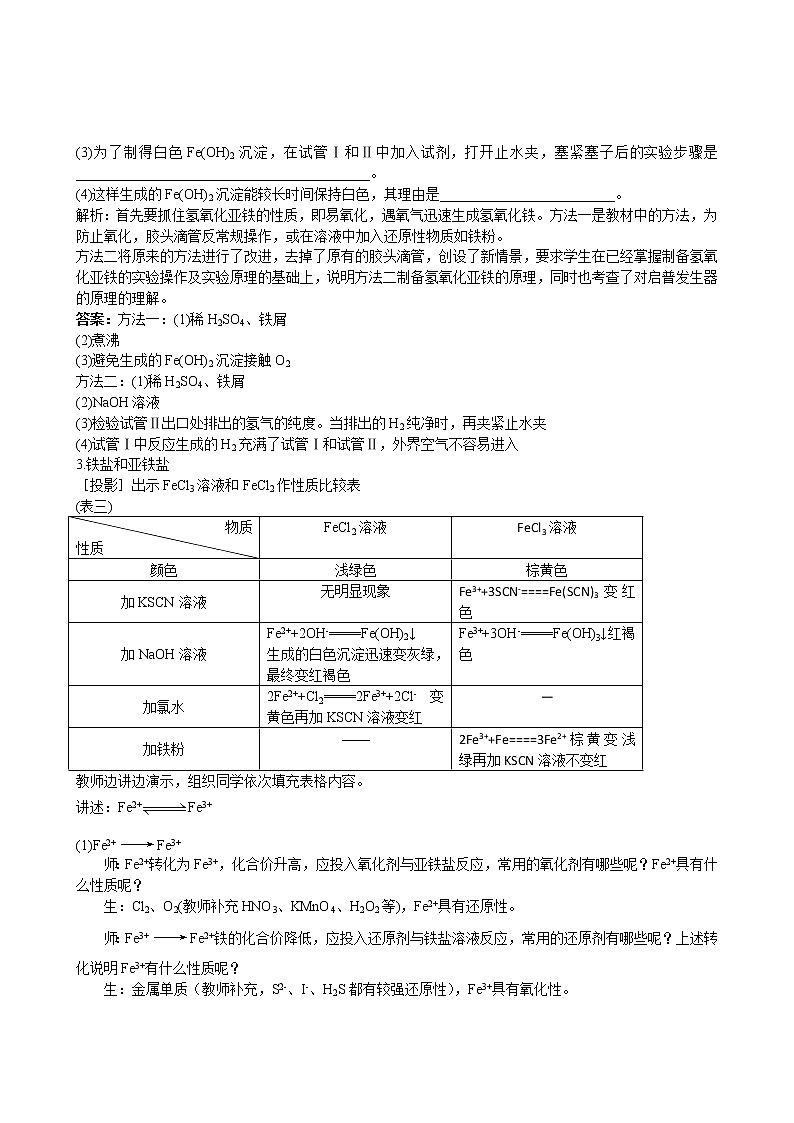
3.铁盐和亚铁盐
[投影]出示FeCl3溶液和FeCl2作性质比较表
(表三)
教师边讲边演示,组织同学依次填充表格内容。
讲述:Fe2+Fe3+
(1)Fe2+Fe3+
师:Fe2+转化为Fe3+,化合价升高,应投入氧化剂与亚铁盐反应,常用的氧化剂有哪些呢?Fe2+具有什么性质呢?
生:Cl2、O2(教师补充HNO3、KMnO4、H2O2等),Fe2+具有还原性。
师:Fe3+Fe2+铁的化合价降低,应投入还原剂与铁盐溶液反应,常用的还原剂有哪些呢?上述转化说明Fe3+有什么性质呢?
生:金属单质(教师补充,S2-、I-、H2S都有较强还原性),Fe3+具有氧化性。
[小结] 铁三角
[例题剖析]
(例2)将Fe粉、Cu粉、FeCl3溶液、FeCl2溶液和CuCl2溶液混合于某容器中充分反应(假定容器不参与反应),试判断下列情况下溶液中存在的金属离子和金属单质。
(1)若铁粉有剩余,则容器中不可能有______________。
(2)若氯化铜有剩余,则容器中还可能有______________。
(3)若氯化铁和氯化铜都有剩余,则容器中不可能有______________,一定有______________。
(4)若氯化铁有剩余,则容器中不可能有______________。
解析:该题属物质共存问题,解答该题应首先弄清物质间可能发生的反应,凡相互间能发生反应的物质,就不可能(大量)共存。该题涉及的反应有:
①Fe+2FeCl3====3FeCl2
②Fe+CuCl2====Cu+FeCl2
③Cu+2FeCl3====2FeCl2+CuCl2
(1)若Fe粉有剩余,则容器中就不可能有Fe3+、Cu2+,因为它们能发生上述①②反应。
(2)若CuCl2有剩余,则容器中不可能有Fe,可能有Fe2+、Fe3+,一定有Fe2+。
(3)若FeCl3和CuCl2均有剩余,则容器中不可能有Fe、Cu,可能有Fe2+。
(4)若FeCl3有剩余,则容器中不可能有Fe、Cu。
答案:
(1)Fe3+、Cu2+
(2)Fe2+、Fe3+或Cu、Fe2+
(3)Fe、Cu Fe2+
(4)Fe、Cu
点评:此题实质是对“铁三角”的考查。解题时要掌握单质铁、铜、锌等金属和Fe2+具有还原性,不能在强氧化性条件下存在;Cu2+、Fe3+、H+等具有氧化性,不能在强还原性条件下存在。通过已知条件,结合可能发生的反应,进行对金属离子和金属单质的判断,有时还要考虑金属(如Zn、Fe、Cu)与Fe3+反应的先后顺序。
板书设计
(三)铁的重要化合物
1.铁的氧化物
铁的氧化物性质比较(见表一)
2.铁的氢氧化物
铁的氢氧化物性质比较(见表二)
3.铁盐和亚铁盐(见表三)
小结:铁三角(见图)
活动与探究
1.AlCl3、Al2(SO4)3净水效果比较。
把混有少量泥沙的浑浊水分别加入到3支试管中,向其中2支试管中分别加入AlCl3、Al2(SO4)3溶液,振荡,静置,观察。
2.FeCl3、Fe2(SO4)3净水效果比较。
把混有少量泥沙的浑浊水分别加入到3支试管中,向其中2支试管分别加入FeCl3、Fe2(SO4)3溶液,振荡,静置,观察。
随堂练习
1.将8 g铁片放入100 mL 硫酸铜溶液中,当溶液中的Cu2+全部被还原时,“铁片”的质量变为8.2 g,则原硫酸铜溶液的物质的量浓度为( )
A.0.5 ml ·L-1 ml ·L-1
ml ·L-1 ml ·L-1
答案:C
2.下列各组离子能大量共存于同一溶液中的是( )
A.Fe2+,Ca2+,,Cl- B.Fe3+,NH+4,Cl-,I-
C.Fe2+,H+,,Cl- D.Fe3+,Na+,,OH-
答案:A
3.铁屑溶于过量的稀硫酸,过滤后向滤液中加入适量的硝酸,再加入过量的氨水,有红褐色沉淀生成。过滤,加热沉淀物至质量不再发生变化,得到红棕色的残渣。上述沉淀和残渣分别为( )
A.Fe(OH)3;Fe2O3 B.Fe(OH)2;FeO
C.Fe(OH)2;Fe(OH)3;Fe3O4 D.Fe2O3;Fe(OH)3
答案:A
4.把a g铁铝合金粉末溶于足量盐酸中,加入过量NaOH溶液。过滤出沉淀,经洗涤、干燥、灼烧,得到红色粉末的质量仍为a g,则原合金中铁的质量分数为( )
A.70% B.52.4% C.47.6% D.30%
答案:A
5.某溶液中含有大量Fe2+、Fe3+、Mg2+和NH+4,其c(H+)=10-2 ml ·L-1。在该溶液中可以大量存在的阴离子是( )
A. B. C.SCN- D.
答案:A
6.在氯化铁、氯化铜和盐酸混合溶液中加入铁粉,待反应结束,所剩的固体滤出后能被磁铁吸引,则反应后溶液中存在较多的阳离子是( )
A.Cu2+ B.Fe3+ C.Fe2+ D.H+
答案:C
7.用Fe与含a ml H2SO4的稀硫酸恰好完全反应,FeO与含b ml H2SO4的稀硫酸恰好完全反应,混有少量FeO的Fe与含c ml H2SO4的稀硫酸恰好完全反应,并欲制得等量的绿矾,则下列关系正确的是( )
A.a=b=c B.a>b>c C.b>a>c D.c>b>a
答案:A
8.A、B、C、D、E、F六种物质,它们的组成中有一种元素是相同的。现有以下事实:①A、B都难溶于水,A在空气中易氧化成B;②B受热可分解生成C;③足量的F加入到D的溶液中,充分振荡后生成了浅绿色的E溶液;④往D的溶液中滴入AgNO3溶液,可生成难溶于稀HNO3的白色沉淀,往KSCN溶液中滴入D的溶液振荡呈红色。据上述事实,(1)推断A~F的化学式分别为A.____________、B.____________、C.____________、D.____________、E.____________、F.____________。
(2)请写出①③涉及的化学方程式。
答案:(1) Fe(OH)2 Fe(OH)3 Fe2O3 FeCl3 FeCl2 Fe
(2)①4Fe(OH)2+O2+2H2O====4Fe(OH)3 ③2FeCl3+Fe====3FeCl2
习题详解
1.答案:2Na2O2+2CO2====2Na2CO3+O2
2.答案:强酸 强碱 两性 两性
点拨:Al2O3和Al(OH)3是典型的两性物质,都既能与强酸反应又能与强碱反应。其中Al2O3为两性氧化物,Al(OH)3为两性氢氧化物。
3.答案:产生白色沉淀 沉淀不溶解 产生白色沉淀 沉淀溶解变为澄清溶液
点拨:在MgCl2溶液中加入少量NaOH溶液,发生反应:Mg2++2OH-====Mg(OH)2↓,故有白色沉淀生成;继续加入NaOH溶液,Mg(OH)2不溶解;在AlCl3溶液中加入少量NaOH溶液,发生反应Al3++3OH-====Al(OH)3↓,产生白色沉淀,继续加入NaOH溶液,Al(OH)3会继续与其反应:Al(OH)3+OH-====+2H2O,沉淀会溶解变为澄清溶液。
4.答案:D
点拨:A选项中,Na与H2O反应生成NaOH和H2;B选项中Na2O2与H2O反应生成NaOH和O2;C选项中Ca(OH)2和Na2CO3溶液反应生成NaOH和CaCO3;D选项中的两种物质不反应。
5.答案:B
点拨:Al3+可以在酸性条件下存在,在碱性条件下会生成Al(OH)3,选项中,Cl-、H+、Na+都可与Al3+共存,OH-能与Al3+反应生成Al(OH)3。
6.答案:B
点拨:Ba(OH)2溶液和稀硫酸反应生成BaSO4白色沉淀;与MgCl2溶液反应生成Mg(OH)2白色沉淀,符合题干要求。
7.答案:C
点拨:检验FeCl2是否变质,主要是看Fe2+是否被氧化为Fe3+,即直接检验溶液中Fe3+的存在。选择NaOH可以与Fe3+生成红褐色沉淀Fe(OH)3,但其中Fe2+会生成Fe(OH)2沉淀,Fe(OH)2会由白色变灰绿色最终会变成红褐色的Fe(OH)3,会干扰实验;Fe粉也可以与Fe3+反应而溶解其中,但现象不易观察;石蕊不能作为检验Fe3+的试剂;只有KSCN溶液是最好的检验Fe3+的试剂,加入若呈现血红色,则证明Fe3+存在,反之而不能。
8.答案:D
9.答案:D
10.答案:被氧化:2FeCl2+Cl2====2FeCl3
被还原:Zn+FeCl2====ZnCl2+Fe
11.答案:Cu+2FeCl3====2FeCl2+CuCl2 Cu元素化合价由0变为+2,Fe元素由+3价变为+2价
点拨:刻制印刷电路板是工业利用Cu与FeCl3溶液的反应进行生产的,其反应原理为:Cu+2FeCl3====2FeCl2+CuCl2,离子反应:Cu+2Fe3+====2Fe2++Cu2+。Cu元素化合价由0变为+2,被氧化;Fe元素从+3价降到+2价,被还原。
12.答案:先生成白色沉淀,后迅速变灰绿色,最后变为红褐色 FeSO4+2NaOH====Fe(OH)2
↓+Na2SO4 4Fe(OH)2+O2+2H2O====4Fe(OH)3
点拨:在FeSO4溶液中加入NaOH溶液,会发生反应:Fe2++2OH-====Fe(OH)2↓,Fe(OH)2为白色沉淀,但它很容易被空气中的O2氧化,即4Fe(OH)2+O2+2H2O====4Fe(OH)3↓,但颜色变化是由白色迅速变为灰绿色,最后变为红褐色。
13.答案:设NaHCO3受热分解生成Na2CO3的质量为x
2NaHCO3Na2CO3+CO2↑+H2O
2×84 106
33.6 g x
x==21.2 g
Na2CO3物质的量为=0.2 ml
答:剩余21.2 g Na2CO3,物质的量为0.2 ml。
14.略
FeO
Fe2O3
Fe3O4
颜色、状态
黑色粉末
红棕色粉末
黑色晶体
溶解性
不溶于水
不溶于水
不溶于水
俗名
—
铁红
磁性氧化铁
与酸反应
FeO+2H+====Fe2++H2O
Fe2O3+6H+====2Fe3++3H2O
—
铁的化合价
+2
+3
+2、+3
重要用途
6FeO+O22Fe3O4
制红色油漆和涂料、炼铁
—
物质
制法、性质
Fe(OH)3
Fe(OH)2
实验室制备
Fe3++3OH-====Fe(OH)3↓
Fe2++2OH-====Fe(OH)2↓
颜色、状态
红褐色固体
白色固体、在空气中迅速变灰绿最终变红褐色
溶解性
不溶于水
不溶于水
与酸反应
Fe(OH)3+3H+====Fe3++3H2O
Fe(OH)2+2H+====Fe2++2H2O
稳定性
2Fe(OH)3Fe2O3+3H2O
4Fe(OH)2+O2+2H2O====4Fe(OH)3
物质
性质
FeCl2溶液
FeCl3溶液
颜色
浅绿色
棕黄色
加KSCN溶液
无明显现象
Fe3++3SCN-====Fe(SCN)3变红色
加NaOH溶液
Fe2++2OH-====Fe(OH)2↓
生成的白色沉淀迅速变灰绿,最终变红褐色
Fe3++3OH-====Fe(OH)3↓红褐色
加氯水
2Fe2++Cl2====2Fe3++2Cl-变黄色再加KSCN溶液变红
—
加铁粉
——
2Fe3++Fe====3Fe2+棕黄变浅绿再加KSCN溶液不变红
不加试剂
加入AlCl3
加入Al2(SO4)3
2分钟
4分钟
6分钟
结论
不加试剂
加入AlCl3
加入Al2(SO4)3
2分钟
4分钟
6分钟
结论
高中化学第二节 醛教案: 这是一份高中化学第二节 醛教案,共7页。
人教版 (新课标)必修1第二节 几种重要的金属化合物第3课时教学设计: 这是一份人教版 (新课标)必修1第二节 几种重要的金属化合物第3课时教学设计,共5页。教案主要包含了温故知新,课堂生成,课堂研讨,巩固练习等内容,欢迎下载使用。
高中人教版 (新课标)第二节 几种重要的金属化合物第2课时教学设计: 这是一份高中人教版 (新课标)第二节 几种重要的金属化合物第2课时教学设计,共5页。教案主要包含了温故知新,课堂生成,课堂研讨,巩固练习,课后反思等内容,欢迎下载使用。