
人教版 (新课标)必修1第三节 氧化还原反应第2课时教学设计
展开三维目标
知识与技能
1.应用电子转移的观点进一步理解氧化还原反应。
2.应用电子转移的观点判断、分析氧化还原反应,并能举例说明化学反应中元素化合价的变化与电子转移的关系。
3.认识氧化还原反应中各有关物质的相互关系。
过程与方法
1.经过对氧化还原反应探究的过程,理解科学探究的意义,学习科学探究的基本方法,提高科学探究能力。
2.能够发现和提出有探究价值的化学问题,敢于质疑,勤于思索,逐步形成独立思考的能力,善于与人合作,具有团队精神。
情感、态度与价值观
1.发展学习化学的兴趣,乐于探究氧化还原反应的奥秘,体验科学探究的艰辛和喜悦,感受化学世界的奇妙与和谐。
2.树立辩证唯物主义的世界观,养成求真务实、勇于创新、积极实践的科学态度。
教学重点
1.氧化还原反应的实质
2.氧化剂、还原剂
教学难点
1.氧化还原反应的实质
2.培养探究能力、思维能力、归纳能力
教具准备
多媒体课件、投影仪
教学过程
导入新课
【投影】
1.什么叫氧化反应?什么叫还原反应?
生:氧化反应:元素化合价升高的反应。
还原反应:元素化合价降低的反应。
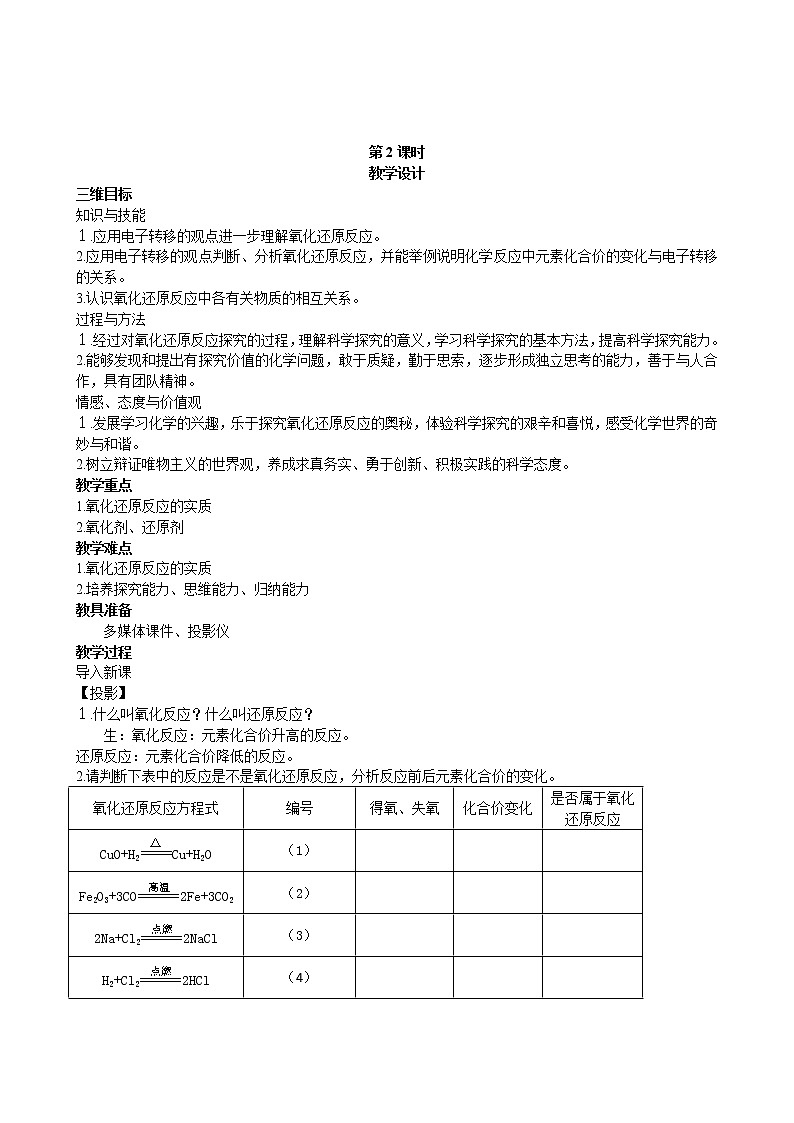
2.请判断下表中的反应是不是氧化还原反应,分析反应前后元素化合价的变化。
生:(1)和(2)是物质得氧、失氧的化学反应,反应前后元素化合价发生了变化,是氧化还原反应。(3)和(4)反应中没有氧的得失,但反应前后元素化合价发生了变化,也是氧化还原反应。
师:(3)和(4)也是氧化还原反应,那么,反应前后元素化合价的变化与电子得失又是什么关系?这就要从微观的角度上认识氧化还原反应。
推进新课
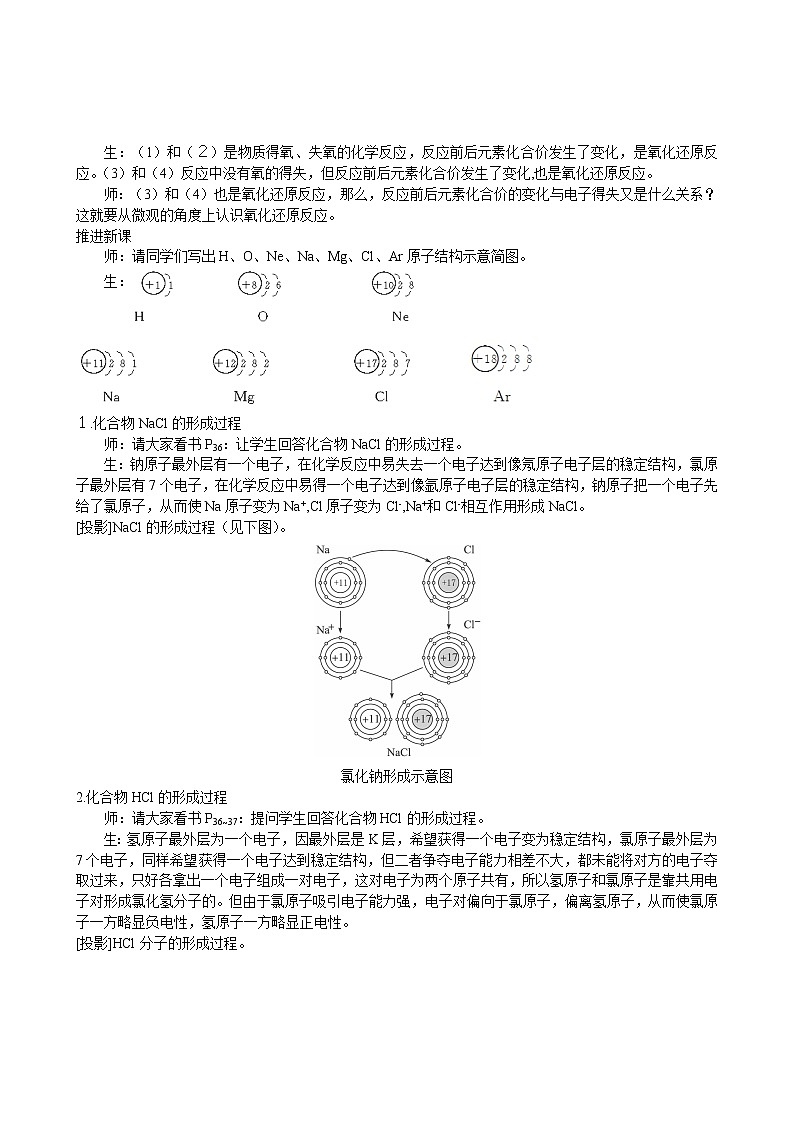
师:请同学们写出H、O、Ne、Na、Mg、Cl、Ar原子结构示意简图。
生:
1.化合物NaCl的形成过程
师:请大家看书P36:让学生回答化合物NaCl的形成过程。
生:钠原子最外层有一个电子,在化学反应中易失去一个电子达到像氖原子电子层的稳定结构,氯原子最外层有7个电子,在化学反应中易得一个电子达到像氩原子电子层的稳定结构,钠原子把一个电子先给了氯原子,从而使Na原子变为Na+,Cl原子变为Cl-,Na+和Cl-相互作用形成NaCl。
[投影]NaCl的形成过程(见下图)。
氯化钠形成示意图
2.化合物HCl的形成过程
师:请大家看书P36~37:提问学生回答化合物HCl的形成过程。
生:氢原子最外层为一个电子,因最外层是K层,希望获得一个电子变为稳定结构,氯原子最外层为7个电子,同样希望获得一个电子达到稳定结构,但二者争夺电子能力相差不大,都未能将对方的电子夺取过来,只好各拿出一个电子组成一对电子,这对电子为两个原子共有,所以氢原子和氯原子是靠共用电子对形成氯化氢分子的。但由于氯原子吸引电子能力强,电子对偏向于氯原子,偏离氢原子,从而使氯原子一方略显负电性,氢原子一方略显正电性。
[投影]HCl分子的形成过程。
学生讨论:在化合物中,化合价是如何确定的?
[投影]请学生填写下表:
[知识拓展]
师:元素的化合价变化与电子得失或电子对偏移有什么关系?
生:在氧化还原反应中,得电子(或电子对偏向)表现为所含元素化合价降低,失电子(或电子对偏离)表现为所含元素化合价升高。
师:氧化还原反应的实质是什么?
生:氧化还原反应的实质是电子发生转移(电子的得失或电子对偏移)。
师:根据元素的化合价变化与电子得失或电子对偏移的关系,从电子得失的角度分析什么是氧化反应、还原反应?
生:失去电子的反应为氧化反应,得到电子的反应为还原反应。
[板书]二、氧化还原反应的概念
[合作探究]
[板书]1.氧化反应(被氧化):指反应物中的某元素失电子、化合价升高的反应过程。
师:上述概念应从哪几方面理解?
生:(1)氧化反应的对象是反应物中的某元素;
(2)氧化反应的本质是元素的原子失去电子;
(3)氧化反应的特征是元素化合价升高;
(4)氧化反应对反应过程而言。
[板书]2.还原反应(被还原):指反应物中某元素得电子、化合价降低的反应过程。
师:上述概念应有哪几方面理解?
(1)还原反应的对象是反应物中的某元素;
(2)还原反应的本质是元素的原子得到电子;
(3)还原反应的特征是元素化合价降低;
(4)还原反应对反应过程而言。
[板书]3.氧化还原反应:凡是有电子转移的反应叫氧化还原反应。
师:如何认识氧化还原反应中各有关物质?
[板书]三、氧化剂、还原剂
1.氧化剂:指反应物中含得电子元素的物质。
师:上述概念应从哪几方面理解?
生:(1)氧化剂是指反应物;
(2)其本质是得电子,特征为化合价降低。
(3)氧化剂具有氧化性。
2.还原剂:反应物中含有失电子元素的物质。
师:上述概念应从哪几方面理解?
生:(1)还原剂指反应物;
(2)其本质为失电子,特征是化合价升高。
(3)还原剂具有还原性。
3.常见氧化剂、还原剂
师:常见氧化剂:常见非金属单质如O2、Cl2、Br2等;常见元素最高价化合物如KMnO4、HNO3、浓H2SO4等。
常见还原剂:金属单质如Fe、Cu、Zn等;常见元素最低价化合物如Na2S、KI等。
[设问]元素的最高价有氧化性,最低价有还原性,中间价态具有何种性质?
生:元素的中间价态既具有氧化性,又具有还原性,其化合物既可作氧化剂,又可作还原剂。如:Fe只作还原剂,FeCl3只作氧化剂,Fe2+既可作氧化剂,又可作还原剂。
[课堂小结]
本节课我们进一步学习了氧化还原反应的知识,认识了氧化还原反应的本质是电子的转移,要求同学们能够理解氧化还原反应的发展历史:从得氧、失氧,到化合价变化,到电子转移。
[板书]四、氧化还原反应的本质是电子转移;氧化还原反应的特征是化合价变化。
“氧化”与“还原”既对立又统一。
[学与问]化合反应、分解反应、置换反应与氧化还原反应的相互关系
板书设计
二、氧化还原反应概念
1.氧化反应(被氧化)
2.还原反应(被还原)
3.氧化还原反应
三、氧化剂、还原剂
1.氧化剂
2.还原剂
3.常见的氧化剂、还原剂
四、氧化还原反应的本质是电子转移;特征是化合价变化。“氧化”与“还原”既对立又统一。
活动与探究
氧化还原反应在日常生活、工农业生产中都有广泛的应用,请调查列举在日常生活、工农业生产中运用的氧化还原反应的实例。
提示:日常生活中:煤、煤气、天然气的燃烧,酿酒,炒菜,食物的腐败,食物在人体中被消化,人和动物的呼吸等。
工业生产中:金属的冶炼、石油化工、合成氨工业、三酸二碱的生产、日用化工、电镀、干电池、蓄电池及尖端的空间技术上用的高能燃料电池等。
农业生产中:植物的光合作用、施入土壤中的肥料发生的变化、土壤结构中的许多物质发生的变化、农药的制取等。
随堂练习
1.在S2-、Fe2+、Fe3+、Mg2+、S、I-、H+中,只有氧化性的是_____________,只有还原性的是_____________,既有氧化性又有还原性的是__________________________。
答案:Fe3+、Mg2+、H+ S2-、I- Fe2+、S
2.以下关于化学反应KClO3+6HCl====KCl+3Cl2+3H2O中,电子转移的方向和数目的叙述正确的是( )
A.由转移,共6e- B.由转移,共5e-
C.由转移,共6e- D.由转移,共5e-
答案:B
3.已知下列两氧化还原反应:
O2+4HI====2I2+2H2O Na2S+I2====2NaI+S
试比较三种单质的氧化性强弱顺序_______________________。
答案:O2>I2>S
4.单质X和Y相互反应生成X2+Y2-,现有下列叙述:①X被氧化 ②X是氧化剂 ③X具有氧化性 ④Y2-是还原产物 ⑤Y2-具有还原性 ⑥X2+具有氧化性 ⑦Y的氧化性比X2+氧化性强,其中正确的是( )
A.①②③④ B.①④⑤⑥⑦
C.②③④ D.①③④⑤
答案:B
5.在3Cu+8HNO3====3Cu(NO3)2+2NO↑+4H2O的反应中,有6.4 g铜被氧化,参加反应的HNO3的质量是____________g,被还原的HNO3质量是____________g。
分析:铜和参加反应的HNO3的量的关系是:
3Cu ~ 8HNO3
3×64 8×63
6.4 g x x=16.8 g
铜和被还原的HNO3的量的关系是:
3Cu ~ 2HNO3
3×64 2×63
6.4 g y y=4.2 g
答案:16.8 4.2
6.对于反应Zn+2HCl====ZnCl2+H2↑,HCl是____________。
对于反应MnO2+4HClMnCl2+Cl2↑+2H2O,HCl是。
答案:氧化剂 还原剂
7.以下反应中属于氧化还原反应的是( )
A.Fe+CuSO4====FeSO4+Cu
B.2NaOH+H2SO4====Na2SO4+2H2O
C.CuO+2HCl====CuCl2+H2O
D.CaCO3+2HCl====CaCl2+CO2↑+H2O
答案:A
8.标出下列反应中的氧化剂、还原剂。
①2CO+O22CO2
②2H2O2H2↑+O2↑
③2KClO32HCl+3O2↑
答案:氧化剂:①O2 ②H2O ③KClO3
还原剂:①CO ②H2O ③KClO3
习题详题
1.答案:电子 氧化还原 失去 氧化 还原 得到 还原 氧化
2.答案:Cl2、O2、KMnO4、HNO3、浓硫酸、FeCl3 Al、Zn、Fe C、H2、CO等
3.答案:氧化 S+O2SO2 还原
点拨:高温时水蒸气与碳发生反应:C+H2OCO+H2,其中C元素化合价升高,C为还原剂;H元素化合价降低,H2O为氧化剂。同理硫在氧气中燃烧,硫作还原剂。
4.C
5.D
6.答案:C
点拨:判断一个反应是否是氧化还原反应,关键看其中是否有元素化合价发生变化,A、B、D中均无元素化合价发生变化,只有C项中O元素由-1价分别变为-2价和0价。
7.答案:C B
点拨:四个反应中HCl中Cl元素发生变化的是C项,由-1价变为0价,被氧化;HCl中H元素发生变化的是B项,由+1价变为0价,被还原。
8.答案:BC
点拨:铁与CuSO4的反应中:Fe+CuSO4====FeSO4+Cu,铁元素化合价升高,铁作还原剂,被氧化。
9.
答案:(1)氧化剂:O2;还原剂:H2
(2)氧化剂:O2,还原剂:P
(3)氧化剂、还原剂均为KClO3
(4)氧化剂、还原剂均为HgO
(5)氧化剂:WO3;还原剂:H2
点拨:(1)在2H2+O22H2O中,H元素化合价升高,H2作还原剂,O元素化合价降低,O2作氧化剂;(2)同理,P为还原剂,O2为氧化剂;(3)在反应2KClO32KCl+3O2↑中,Cl元素化合价降低,O元素化合价升高,故KClO3既为氧化剂又为还原剂;(4)同(3),HgO既为氧化剂又为还原剂;(5)H2还原WO3类似H2还原CuO,WO3作氧化剂,H2作还原剂。
10.答案:①C+O2CO2
②2C+O22CO
③2CO+O22CO2
④CO2+C2CO
⑤CO2+Ca(OH)2====CaCO3↓+H2O
⑥CaCO3CaO+CO2↑
其中①②③④为氧化还原反应,⑤⑥为非氧化还原反应。①中O2为氧化剂,C为还原剂;②中O2为氧化剂,C为还原剂;③中O2为氧化剂,CO为还原剂;④中CO2为氧化剂,C为还原剂。
11.答案:氧化还原反应在工农业生产、科学技术和日常生活中有着重要意义。
①工农业生产:植物光合作用、呼吸作用、肥料在土壤中的变化;冶炼金属、工业合成氨、石油炼制等;
②日常生活:干电池、蓄电池等。
氧化还原反应方程式
编号
得氧、失氧
化合价变化
是否属于氧化还原反应
CuO+H2Cu+H2O
(1)
Fe2O3+3CO2Fe+3CO2
(2)
2Na+Cl22NaCl
(3)
H2+Cl22HCl
(4)
化合物
正价
负价
价数
标出化合价
NaCl
失电子,电子显正价
得电子,电子显负价
一个原子得失电子数目
HCl
电子对偏离,显正价
电子对偏向,显负价
一个原子与其他原子共用电子对数目
2022高考化学一轮复习教案:第2章 第8讲 氧化还原反应的配平及计算: 这是一份2022高考化学一轮复习教案:第2章 第8讲 氧化还原反应的配平及计算,共13页。
2022高考化学一轮复习教案:第2章 第7讲 氧化还原反应的规律及应用: 这是一份2022高考化学一轮复习教案:第2章 第7讲 氧化还原反应的规律及应用,共20页。
2021学年第三节 卤代烃教案及反思: 这是一份2021学年第三节 卤代烃教案及反思,共3页。教案主要包含了从电子得失的观点分析 二等内容,欢迎下载使用。













