




还剩16页未读,
继续阅读
人教版 (新课标)选修4 化学反应原理第三节 化学反应热的计算课堂教学ppt课件
展开
这是一份人教版 (新课标)选修4 化学反应原理第三节 化学反应热的计算课堂教学ppt课件,共24页。PPT课件主要包含了盖斯定律,注意要点,反应热的计算,反应热的计算依据等内容,欢迎下载使用。
在化学科研中,经常要通过实验测定物质在发生化学反应时所放出或吸收的热量。但是某些物质的反应热,由于种种原因不能直接测得,只能通过化学计算的方式间接获得。在生产中,对燃料的燃烧、反应条件的控制以及废热的利用,也需要反应热计算 。
1840年,瑞士化学家盖斯(G.H.Hess)通过大量实验事实证明,不管化学反应是一步完成或分几步完成,其反应热是相同的。换句话说,化学反应的反应热只与反应体系的始态和终态有关,而与反应的途径无关。这就是盖斯定律。
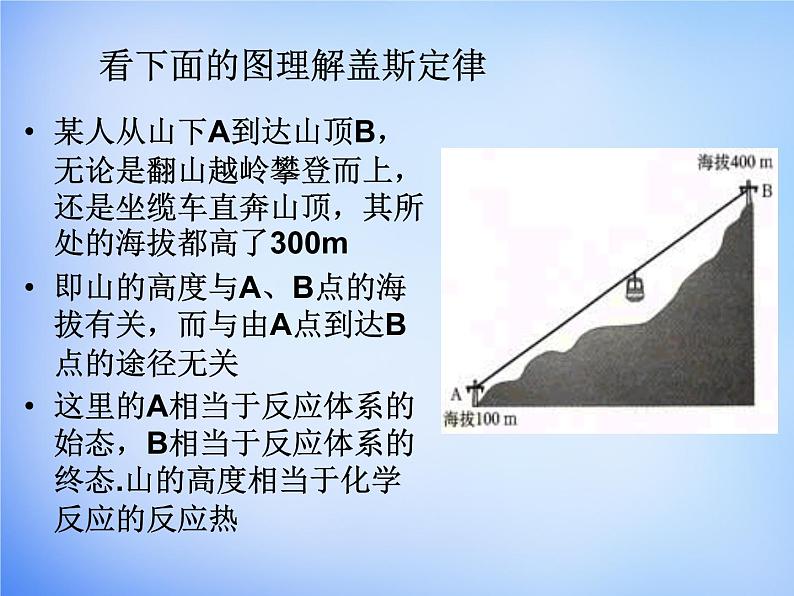
看下面的图理解盖斯定律
某人从山下A到达山顶B,无论是翻山越岭攀登而上,还是坐缆车直奔山顶,其所处的海拔都高了300m即山的高度与A、B点的海拔有关,而与由A点到达B点的途径无关这里的A相当于反应体系的始态,B相当于反应体系的终态.山的高度相当于化学反应的反应热
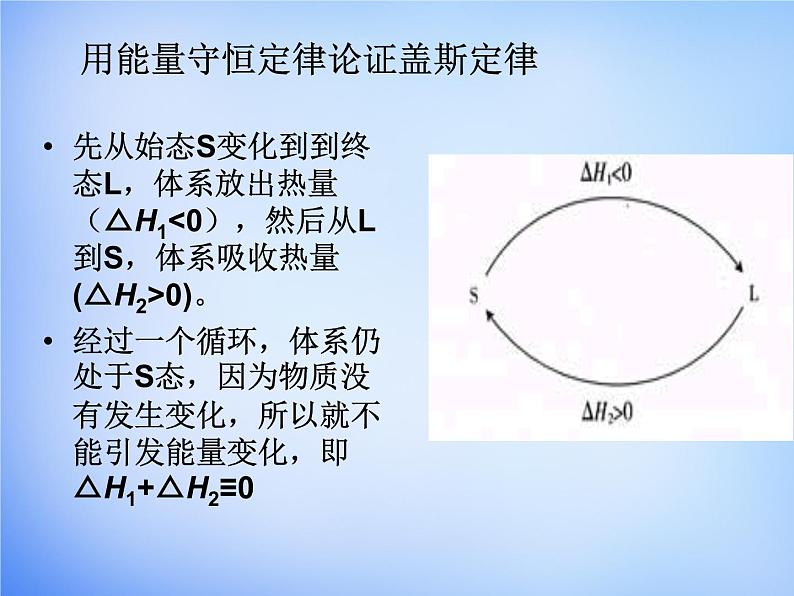
用能量守恒定律论证盖斯定律
先从始态S变化到到终态L,体系放出热量(△H1<0),然后从L到S,体系吸收热量(△H2>0)。经过一个循环,体系仍处于S态,因为物质没有发生变化,所以就不能引发能量变化,即△H1+△H2≡0
盖斯定律在科学研究中的重要意义
有些反应进行得很慢有些反应不容易直接发生有些反应的产品不纯(有副反应发生)这些都给测量反应热造成了困难利用盖斯定律可以间接地把它们的反应热计算出来
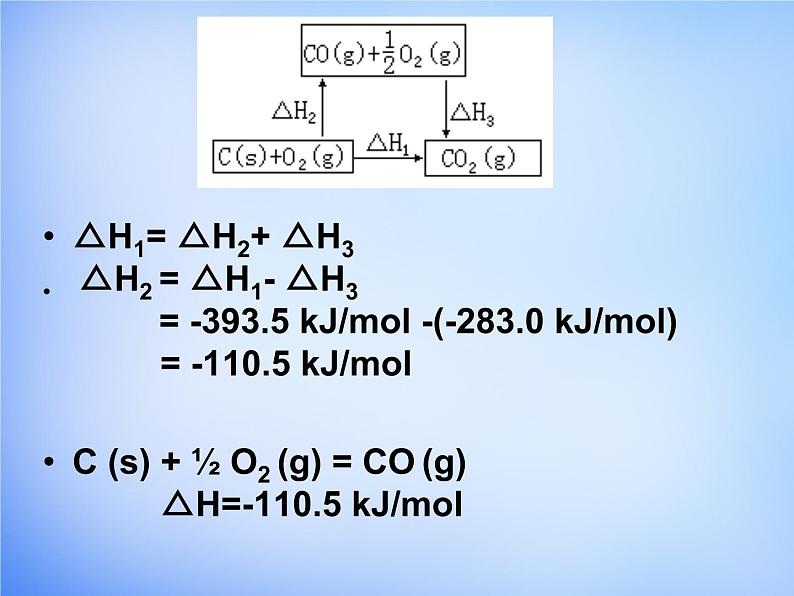
C(s)+ ½ O2(g)=CO(g)因为C燃烧时不可能完全生成CO,总有一部分CO2生成,因此这个反应的ΔH无法直接测得,请同学们自己根据盖斯定律设计一个方案计算该反应的ΔH。提示(1) C(s) + O2(g) = CO2(g) △H1=-393.5 kJ/ml (2) CO(g) + ½O2(g) = CO2(g) △H3=-283.0 kJ/ml
△H1= △H2+ △H3 △H2 = △H1- △H3 = -393.5 kJ/ml -(-283.0 kJ/ml) = -110.5 kJ/mlC (s) + ½ O2 (g) = CO (g) △H=-110.5 kJ/ml
同素异形体相互转化但反应热相当小而且转化速率慢,有时还很不完全,测定反应热很困难。现在可根据盖斯提出的观点“不管化学反应是一步完成或分几步完成,这个总过程的热效应是相同的”。已知:
P4(s、白磷)+5O2(g)=P4O10(s); = -2983.2 kJ/ml
P(s、红磷)+5/4O2(g)=1/4P4O10(s); = -738.5 kJ/ml
试写出白磷转化为红磷的热化学方程式_________________________________。
1、热化学方程式同乘以一个数时,反应热数值也必须同乘以该数值;2、热化学方程式相加减时,同种物质之间可相加减,反应热也随之相加减;3、将一个热化学方程式颠倒时, △H的符号也要随之改变
有关热化学方程式的计算【例1】25℃、101kPa时,使1.0 g钠与足量的氯气反应,生成氯钠晶体并放出17.87 kJ的热量,求生成1 ml氯化钠的反应热。
【解】Na(g) + ½ Cl2(g) == NaCl(s)17.87 kJ / 1g × 23 g / ml = 411 kJ / ml答:生成1 ml NaCl的反应热为-411 kJ / ml
变式练习CH4 (g) + 2O2(g)= CO2 (g) + 2H2 O (l); △ H= -Q1 KJ/ml2H2(g)+O2(g) = 2H2 O (g); △ H= -Q2 KJ/ml2H2(g)+O2(g) = 2H2 O (l); △ H=- Q3 KJ/ml 常温下,取体积比4:1的甲烷和氢气的混合气体11.2L(标况),经完全燃烧恢复常温,放出的热为:
0.4Q1+0.05Q3
有关燃烧热的计算【例2】乙醇的燃烧热△H=-1366.8 kJ/ ml,在25℃、101kPa时,1 kg 乙醇充分燃烧后放出多少热量?
【解】n(C2H5OH)= 1000 g / 46g/ml =21.74ml 1 kg C2H5OH燃烧后产生的热量: 1366.8 kJ/ ml× 21.74ml=2.971 ×104kJ答:1 kg C2H5OH燃烧后放出2.971 ×104kJ的热量。
已知25℃、101kPa下,石墨、金刚石燃烧的热化学方程式分别为: 据此判断,下列说法正确的是( ) A. 由石墨制备金刚石是吸热反应;等质量时,石墨的能量比金刚石的低 B. 由石墨制备金刚石是吸热反应;等质量时,石墨的能量比金刚石的高; C. 由石墨制备金刚石是放热反应;等质量时,石墨的能量比金刚石的低 D. 由石墨制备金刚石是放热反应;等质量时,石墨的能量比金刚石的高
①C(s ,石墨)+O2(g)= CO2(g) △H1=-393.5kJ/ml②C(s ,金刚石)+O2(g)= CO2(g) △H2=-395.0kJ/ml
在100 g 碳不完全燃烧所得气体中,CO占1/3体积,CO2占2/3体积,且C(s) +1/2O2(g) = CO(g); = -110.35 kJ/mlCO(g) + 1/2O2(g) = CO2(g); = -282.57 kJ/ml与这些碳完全燃烧相比,损失的热量是( )392.92 kJ B. 2489.44 kJ C. 784.92 kJ D. 3274.3 kJ
应用盖斯定律的计算【例3】已知下列反应的反应热为⑴ CH3COOH (l) + 2O2(g) == 2CO2(g) + 2H2O(l) △H1= -870.3 kJ/ml⑵ C(s) + O2 (g) == CO2(g) △H2= -393.5 kJ/ml⑶ H2(g) + ½ O2(g) == H2O(l) △H3= -285.8 kJ/ml试计算下述反应的反应热:2C(s) + 2H2 (g) + O2 (g) == CH3COOH (l)
【解】分析各方程式的关系,知 将方程式按2[⑵ + ⑶] - ⑴组合得上述反应方程式即:△H = 2[△H 2 + △H3] - △H1△H =2[(-393.5kJ/ml) + (-285.8kJ/ml)] -(-870.3kJ/ml) = - 488.3kJ/ml答:反应2C(s) + 2H2 (g) + O2 (g) == CH3COOH (l) 反应热为- 488.3kJ/ml
1、火箭发射时用肼N2H4(l)作燃料,NO2作氧化剂,反应生成N2和H2O(l),查课本第7面上相关数据写出该反应的热化学方程式。
N2 (g) + 2O2 (g) = 2NO2 (g) △H = +68 kJ/mlN2H4(l) + O2 (g) = N2(g) +2 H2O(l) △H = - 622kJ/mlN2H4(l) + NO2 (g) = 3/2 N2(g) +2 H2O(l) △H =-622kJ/ml –( 68kJ/ml )/2 =-656kJ/ml
2、将煤转化为水煤气的主要反应为:C (s) + H2O(g) = CO(g) + H2(g) .已知:C (s) + O2(g) = CO2(g) △H1=-393.5kJ/mlH2(g) + ½ O2(g) = H2O(g) △H2=-242.0kJ/mlCO(g) + ½ O2(g) = CO2(g) △H3=-283.0kJ/ml⑴写出制取水煤气的热化学方程式.
C (s) + H2O(g) = CO(g) + H2(g) △H=+110.5kJ/ml
⑵比较反应热数据可知,1ml H2和1ml CO完全燃烧放出的热量之和比1ml C (s)完全燃烧放出的热量( )。甲同学据此认为“煤炭燃烧时加用量水可以使煤炭燃烧时放出更多的热量”。乙同学根据盖斯定律通过计算,认为“将煤转化为水煤气再燃烧放出的热量与直接燃烧煤放出的热量一样多”。你的观点呢?乙同学是怎样计算的?你能重现乙的计算过程吗?
乙同学的计算过程:C (s) + H2O(g) + O2(g) → CO2(g) + H2O(g) △H1C (s)+H2O(g)+O2(g) → CO(g)+ H2(g)+O2(g) △H2CO(g)+H2(g)+O2(g) →CO(g)+H2O(g)+1/2O2(g) △H3CO(g)+H2O(g)+1/2O2(g) →CO2(g)+H2O(g) △H4则有: △H1 = △H2+△H3+ △H4
反应热计算的常见题型:1、化学反应中物质的量的变化与反应能量变化的定量计算。2、理论推算反应热: 依据:物质变化决定能量变化 (1)盖斯定律 (2)通过已知热化学方程式的相加,得出新的热化学方程式:
设计合理路径 路径1总能量变化等于路径2总能量变化
物质的叠加,反应热的叠加
1)热化学方程式与数学上的代数方程式相似,可以移项同时改变正负号,各项的化学计量数包括△H的数值可以同时扩大或缩小相同的倍数;2)根据盖斯定律,可以将两个或两个以上的热化学方程式包括其△H相加或相减,得到一个新的热化学方程式;3)可燃物完全燃烧产生的热量=可燃物的物质的量×燃烧热;
在化学科研中,经常要通过实验测定物质在发生化学反应时所放出或吸收的热量。但是某些物质的反应热,由于种种原因不能直接测得,只能通过化学计算的方式间接获得。在生产中,对燃料的燃烧、反应条件的控制以及废热的利用,也需要反应热计算 。
1840年,瑞士化学家盖斯(G.H.Hess)通过大量实验事实证明,不管化学反应是一步完成或分几步完成,其反应热是相同的。换句话说,化学反应的反应热只与反应体系的始态和终态有关,而与反应的途径无关。这就是盖斯定律。
看下面的图理解盖斯定律
某人从山下A到达山顶B,无论是翻山越岭攀登而上,还是坐缆车直奔山顶,其所处的海拔都高了300m即山的高度与A、B点的海拔有关,而与由A点到达B点的途径无关这里的A相当于反应体系的始态,B相当于反应体系的终态.山的高度相当于化学反应的反应热
用能量守恒定律论证盖斯定律
先从始态S变化到到终态L,体系放出热量(△H1<0),然后从L到S,体系吸收热量(△H2>0)。经过一个循环,体系仍处于S态,因为物质没有发生变化,所以就不能引发能量变化,即△H1+△H2≡0
盖斯定律在科学研究中的重要意义
有些反应进行得很慢有些反应不容易直接发生有些反应的产品不纯(有副反应发生)这些都给测量反应热造成了困难利用盖斯定律可以间接地把它们的反应热计算出来
C(s)+ ½ O2(g)=CO(g)因为C燃烧时不可能完全生成CO,总有一部分CO2生成,因此这个反应的ΔH无法直接测得,请同学们自己根据盖斯定律设计一个方案计算该反应的ΔH。提示(1) C(s) + O2(g) = CO2(g) △H1=-393.5 kJ/ml (2) CO(g) + ½O2(g) = CO2(g) △H3=-283.0 kJ/ml
△H1= △H2+ △H3 △H2 = △H1- △H3 = -393.5 kJ/ml -(-283.0 kJ/ml) = -110.5 kJ/mlC (s) + ½ O2 (g) = CO (g) △H=-110.5 kJ/ml
同素异形体相互转化但反应热相当小而且转化速率慢,有时还很不完全,测定反应热很困难。现在可根据盖斯提出的观点“不管化学反应是一步完成或分几步完成,这个总过程的热效应是相同的”。已知:
P4(s、白磷)+5O2(g)=P4O10(s); = -2983.2 kJ/ml
P(s、红磷)+5/4O2(g)=1/4P4O10(s); = -738.5 kJ/ml
试写出白磷转化为红磷的热化学方程式_________________________________。
1、热化学方程式同乘以一个数时,反应热数值也必须同乘以该数值;2、热化学方程式相加减时,同种物质之间可相加减,反应热也随之相加减;3、将一个热化学方程式颠倒时, △H的符号也要随之改变
有关热化学方程式的计算【例1】25℃、101kPa时,使1.0 g钠与足量的氯气反应,生成氯钠晶体并放出17.87 kJ的热量,求生成1 ml氯化钠的反应热。
【解】Na(g) + ½ Cl2(g) == NaCl(s)17.87 kJ / 1g × 23 g / ml = 411 kJ / ml答:生成1 ml NaCl的反应热为-411 kJ / ml
变式练习CH4 (g) + 2O2(g)= CO2 (g) + 2H2 O (l); △ H= -Q1 KJ/ml2H2(g)+O2(g) = 2H2 O (g); △ H= -Q2 KJ/ml2H2(g)+O2(g) = 2H2 O (l); △ H=- Q3 KJ/ml 常温下,取体积比4:1的甲烷和氢气的混合气体11.2L(标况),经完全燃烧恢复常温,放出的热为:
0.4Q1+0.05Q3
有关燃烧热的计算【例2】乙醇的燃烧热△H=-1366.8 kJ/ ml,在25℃、101kPa时,1 kg 乙醇充分燃烧后放出多少热量?
【解】n(C2H5OH)= 1000 g / 46g/ml =21.74ml 1 kg C2H5OH燃烧后产生的热量: 1366.8 kJ/ ml× 21.74ml=2.971 ×104kJ答:1 kg C2H5OH燃烧后放出2.971 ×104kJ的热量。
已知25℃、101kPa下,石墨、金刚石燃烧的热化学方程式分别为: 据此判断,下列说法正确的是( ) A. 由石墨制备金刚石是吸热反应;等质量时,石墨的能量比金刚石的低 B. 由石墨制备金刚石是吸热反应;等质量时,石墨的能量比金刚石的高; C. 由石墨制备金刚石是放热反应;等质量时,石墨的能量比金刚石的低 D. 由石墨制备金刚石是放热反应;等质量时,石墨的能量比金刚石的高
①C(s ,石墨)+O2(g)= CO2(g) △H1=-393.5kJ/ml②C(s ,金刚石)+O2(g)= CO2(g) △H2=-395.0kJ/ml
在100 g 碳不完全燃烧所得气体中,CO占1/3体积,CO2占2/3体积,且C(s) +1/2O2(g) = CO(g); = -110.35 kJ/mlCO(g) + 1/2O2(g) = CO2(g); = -282.57 kJ/ml与这些碳完全燃烧相比,损失的热量是( )392.92 kJ B. 2489.44 kJ C. 784.92 kJ D. 3274.3 kJ
应用盖斯定律的计算【例3】已知下列反应的反应热为⑴ CH3COOH (l) + 2O2(g) == 2CO2(g) + 2H2O(l) △H1= -870.3 kJ/ml⑵ C(s) + O2 (g) == CO2(g) △H2= -393.5 kJ/ml⑶ H2(g) + ½ O2(g) == H2O(l) △H3= -285.8 kJ/ml试计算下述反应的反应热:2C(s) + 2H2 (g) + O2 (g) == CH3COOH (l)
【解】分析各方程式的关系,知 将方程式按2[⑵ + ⑶] - ⑴组合得上述反应方程式即:△H = 2[△H 2 + △H3] - △H1△H =2[(-393.5kJ/ml) + (-285.8kJ/ml)] -(-870.3kJ/ml) = - 488.3kJ/ml答:反应2C(s) + 2H2 (g) + O2 (g) == CH3COOH (l) 反应热为- 488.3kJ/ml
1、火箭发射时用肼N2H4(l)作燃料,NO2作氧化剂,反应生成N2和H2O(l),查课本第7面上相关数据写出该反应的热化学方程式。
N2 (g) + 2O2 (g) = 2NO2 (g) △H = +68 kJ/mlN2H4(l) + O2 (g) = N2(g) +2 H2O(l) △H = - 622kJ/mlN2H4(l) + NO2 (g) = 3/2 N2(g) +2 H2O(l) △H =-622kJ/ml –( 68kJ/ml )/2 =-656kJ/ml
2、将煤转化为水煤气的主要反应为:C (s) + H2O(g) = CO(g) + H2(g) .已知:C (s) + O2(g) = CO2(g) △H1=-393.5kJ/mlH2(g) + ½ O2(g) = H2O(g) △H2=-242.0kJ/mlCO(g) + ½ O2(g) = CO2(g) △H3=-283.0kJ/ml⑴写出制取水煤气的热化学方程式.
C (s) + H2O(g) = CO(g) + H2(g) △H=+110.5kJ/ml
⑵比较反应热数据可知,1ml H2和1ml CO完全燃烧放出的热量之和比1ml C (s)完全燃烧放出的热量( )。甲同学据此认为“煤炭燃烧时加用量水可以使煤炭燃烧时放出更多的热量”。乙同学根据盖斯定律通过计算,认为“将煤转化为水煤气再燃烧放出的热量与直接燃烧煤放出的热量一样多”。你的观点呢?乙同学是怎样计算的?你能重现乙的计算过程吗?
乙同学的计算过程:C (s) + H2O(g) + O2(g) → CO2(g) + H2O(g) △H1C (s)+H2O(g)+O2(g) → CO(g)+ H2(g)+O2(g) △H2CO(g)+H2(g)+O2(g) →CO(g)+H2O(g)+1/2O2(g) △H3CO(g)+H2O(g)+1/2O2(g) →CO2(g)+H2O(g) △H4则有: △H1 = △H2+△H3+ △H4
反应热计算的常见题型:1、化学反应中物质的量的变化与反应能量变化的定量计算。2、理论推算反应热: 依据:物质变化决定能量变化 (1)盖斯定律 (2)通过已知热化学方程式的相加,得出新的热化学方程式:
设计合理路径 路径1总能量变化等于路径2总能量变化
物质的叠加,反应热的叠加
1)热化学方程式与数学上的代数方程式相似,可以移项同时改变正负号,各项的化学计量数包括△H的数值可以同时扩大或缩小相同的倍数;2)根据盖斯定律,可以将两个或两个以上的热化学方程式包括其△H相加或相减,得到一个新的热化学方程式;3)可燃物完全燃烧产生的热量=可燃物的物质的量×燃烧热;













