






高中化学人教版 (2019)必修 第一册实验活动2 铁及其化合物的性质教学演示ppt课件
展开人类在四千五百多年前就开始使用铁器。铁是目前产量最大、使用最广泛的金属。铁及其化合物具有怎样的性质?应当如何研究呢?
实践是检验真理的唯一标准。通过化学实验探究,我们可以了解和学习到铁及其化合物的相关性质。铁、铁盐、亚铁盐、铁离子……
试管、胶头滴管。CuSO4溶液、FeCl3稀溶液、FeCl2溶液、FeSO4溶液、KMnO4酸性溶液、KSCN溶液、KI溶液、淀粉溶液、蒸馏水、锌片、铜片、铁粉、铁丝。
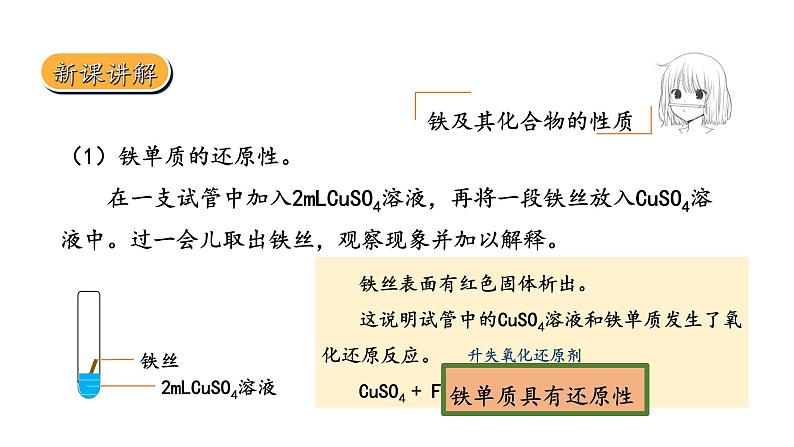
(1)铁单质的还原性。在一支试管中加入2mLCuSO4溶液,再将一段铁丝放入CuSO4溶液中。过一会儿取出铁丝,观察现象并加以解释。
铁丝表面有红色固体析出。这说明试管中的CuSO4溶液和铁单质发生了氧化还原反应。CuSO4 + Fe —— FeSO4 + Cu
(2)铁盐的氧化性。①取3mLFeCl3稀溶液加入试管中,加入几小块铜片,振荡,过一会儿,观察现象。
铜片被腐蚀,溶液变为浅绿色。这说明试管中的FeCl3溶液和铜单质发生了氧化还原反应。Cu + 2FeCl3 —— 2FeCl2 + CuCl2
(2)铁盐的氧化性。②在一支盛有3mL水的试管中滴加几滴FeCl3稀溶液,再滴加3滴KI溶液,观察现象。然后向溶液中滴加2滴淀粉溶液,观察现象。
①几滴FeCl3溶液3滴KI溶液②2滴淀粉溶液
淡黄色溶液变成浅绿色,底部有蓝紫色固体析出。向溶液中滴加淀粉溶液后,溶液变蓝,有络合物产生。 2FeCl3+2KI —— 2KCl+2FeCl2+I2
淀粉遇碘变蓝,因此3价铁盐将KI氧化成I2。
(3)亚铁盐的氧化性和还原性。①取3mLFeCl2稀溶液加入试管中,加入几小块锌片,振荡,过一会儿,观察现象。
有黑色单质铁生成,溶液变为无色。发生了置换反应。FeCl2 + Zn —— ZnCl2 + Fe
活泼金属锌置换出了2价铁盐中的铁单质。
(3)亚铁盐的氧化性和还原性。②在一支试管中加入少量KMnO4酸性溶液,然后向试管中加入少量FeSO4溶液,观察溶液的颜色变化。当溶液紫色褪去时,再滴加2滴KSCN溶液,观察现象。
滴加2滴KSCN溶液后,溶液变红。 KMnO4酸性溶液和FeSO4溶液生成了铁盐。10FeSO4 + 2KMnO4 + 8H2SO4 ——5Fe2(SO4)3 + 2MnSO4 + 8H2O + K2SO4
再滴加2滴KSCN溶液
(1)在一支试管中加入2mL蒸馏水,再滴加几滴FeCl3稀溶液,然后滴加几滴KSCN溶液,观察现象。
几滴FeCl3稀溶液几滴KSCN溶液
溶液变血红色。铁盐会和KSCN反应。FeCl3 + KSCN —— [Fe(SCN)]Cl2(血红色)+ KCl
KSCN溶液和铁离子会反应生成血红色物质
(2)在一支试管中加入少量FeCl3稀溶液,然后加入适量铁粉,轻轻振荡片刻,再滴加几滴KSCN溶液,观察现象。
加入适量铁粉后溶液变绿。滴加几滴KSCN溶液后无明显现象。2FeCl3 + Fe —— 3FeCl2
可以用KSCN溶液检验溶液中是否存在铁离子。
以铁屑为原料,如何制备硫酸亚铁晶体?
KI是常用的还原剂,能被氧化生成I2。淀粉溶液遇I2变蓝。另外,H2S、NH3、H2、C、Si、SnCl2(氯化亚锡)、H2C2O4(草酸)也都可以做还原剂。
1.填写下列横线FeCl3是______色,FeCl2是______色,KSCN是______色。铁单质具有________(还原性/氧化性),铁盐具有_________(还原性/氧化性),亚铁盐具有____________(还原性/氧化性)。
解析:FeCl3是黄棕色,FeCl2是浅绿色,KSCN是无色。铁单质具有还原性,铁盐具有氧化性,亚铁盐具有还原性和氧化性。
2.把铁片放入下列溶液中,铁片溶解,溶液质量增加,但没有气体放出的是( )A.稀硫酸 B.CuSO4溶液C. Fe2(SO4)3溶液 D.AgNO3溶液
解析:选项A中,铁和稀硫酸反应有氢气生成,故A错误;选项B中,铁和硫酸铜发生置换反应,析出铜的质量大于铁的质量,导致溶液质量减小,故B错误;选项C中,铁和硫酸铁反应生成硫酸亚铁,没有气体生成且溶液质量增加,所以符合题意,故C正确;选项D中,铁和硝酸银发生置换反应,析出银的质量大于铁的质量,导致溶液质量减小,故D错误。因此选C。
3.下列化合物不可能由化合反应制得的是( )A.FeCl2 B.NaHCO3 C.Cu(OH)2 D. Fe(OH)3
解析:选项A中,物质可以通过铁和氯化铁的反应制得,故A错误;选项B中,物质可以通过碳酸钠和水和二氧化碳化合反应制得,故B错误;选项C中,物质不可以通过化合反应制得,因为氧化铜和水是不会反应的。只有通过复分解反应才可以制得氢氧化铜,故C正确;选项D中,物质可以通过氢氧化亚铁和氧气和水化合反应制得,故D错误。因此选C。
4.下列各组物质反应后,滴入KSCN溶液一定显红色的是( )A.生了锈的铁块放入稀H2SO4中 B.FeCl3和CuCl2的混合溶液中加入过量的铁粉 C.FeO放入稀HNO3溶液中 D.Fe放入HNO3溶液中
解析:选项A中,生了锈的铁块放入稀H2SO4中,反应生成三价铁离子,再与Fe反应生成亚铁离子,滴入KSCN溶液,溶液不会显示红色,故A错误;选项B中,铁粉过量,铁离子被铁还原成亚铁离子,滴入KSCN溶液,溶液不会显示红色,故B错误;选项C中,FeO和稀HNO3反应会产生三价铁离子,滴入KSCN溶液,溶液会显示红色;选项D中,Fe如果和过量的稀HNO3反应,会产生二价铁离子,滴入KSCN溶液,溶液不会显示红色。因此选C。
CuSO4 + Fe —— FeSO4 + Cu
亚铁盐具有氧化性和还原性
Cu + 2FeCl3 —— 2FeCl2 + CuCl2
2FeCl3+2KI —— 2KCl+2FeCl2+I2
FeCl2 + Zn —— ZnCl2 + Fe
10FeSO4 + 2KMnO4 + 8H2SO4 —— 5Fe2(SO4)3 + 2MnSO4 + 8H2O + K2SO4
FeCl3 + KSCN —— [Fe(SCN)]Cl2(血红色)+ KCl
高中化学人教版 (2019)必修 第一册实验活动2 铁及其化合物的性质说课ppt课件: 这是一份高中化学人教版 (2019)必修 第一册实验活动2 铁及其化合物的性质说课ppt课件,共18页。PPT课件主要包含了自主预习·新知导学,合作探究·释疑解惑,铁离子的检验等内容,欢迎下载使用。
人教版 (2019)实验活动2 铁及其化合物的性质课文ppt课件: 这是一份人教版 (2019)实验活动2 铁及其化合物的性质课文ppt课件,共8页。PPT课件主要包含了2铁盐的氧化性,铜片不断溶解,溶液由棕黄色,逐渐变为浅绿色,Fe3+具有氧化性,溶液由棕黄色变,为浅绿色加入,淀粉溶液后溶,液变为蓝色,I-具有还原性等内容,欢迎下载使用。
浙江专用高中化学实验活动2铁及其化合物的性质课件新人教版必修第一册2: 这是一份浙江专用高中化学实验活动2铁及其化合物的性质课件新人教版必修第一册2,共8页。













