
高中化学人教版 (新课标)选修5 有机化学基础第五章 进入合成高分子化合物的时代第一节 合成高分子化合物的基本方法第1课时精练
展开
这是一份高中化学人教版 (新课标)选修5 有机化学基础第五章 进入合成高分子化合物的时代第一节 合成高分子化合物的基本方法第1课时精练,共9页。试卷主要包含了概念,分类,命名,物理性质,化学性质等内容,欢迎下载使用。
第1课时 醇
知识归纳
1.概念
羟基与__________或__________上的碳原子相连的化合物,其官能团是__________(—OH)。
2.分类
3.命名
(1)选主链
选择含有与_______相连的碳原子的最长碳链为主链,根据碳原子数目称某醇。
(2)编碳号
从离_________最近的一端给主链碳原子依次编号。
(3)标位置
醇的名称前面要用阿拉伯数字标出_______的位置;羟基的个数用二、三等标出。
4.物理性质
(1)沸点
①相对分子质量相近的醇和烷烃相比,醇的沸点远远__________烷烃;
②饱和一元醇,随着分子中碳原子数的增加,沸点逐渐__________;
③醇分子中羟基数目越多,沸点越高。
(2)溶解性:甲醇、乙醇、丙三醇等低级醇均可与水以任意比混溶。
(3)密度:醇的密度一般比水的密度小。
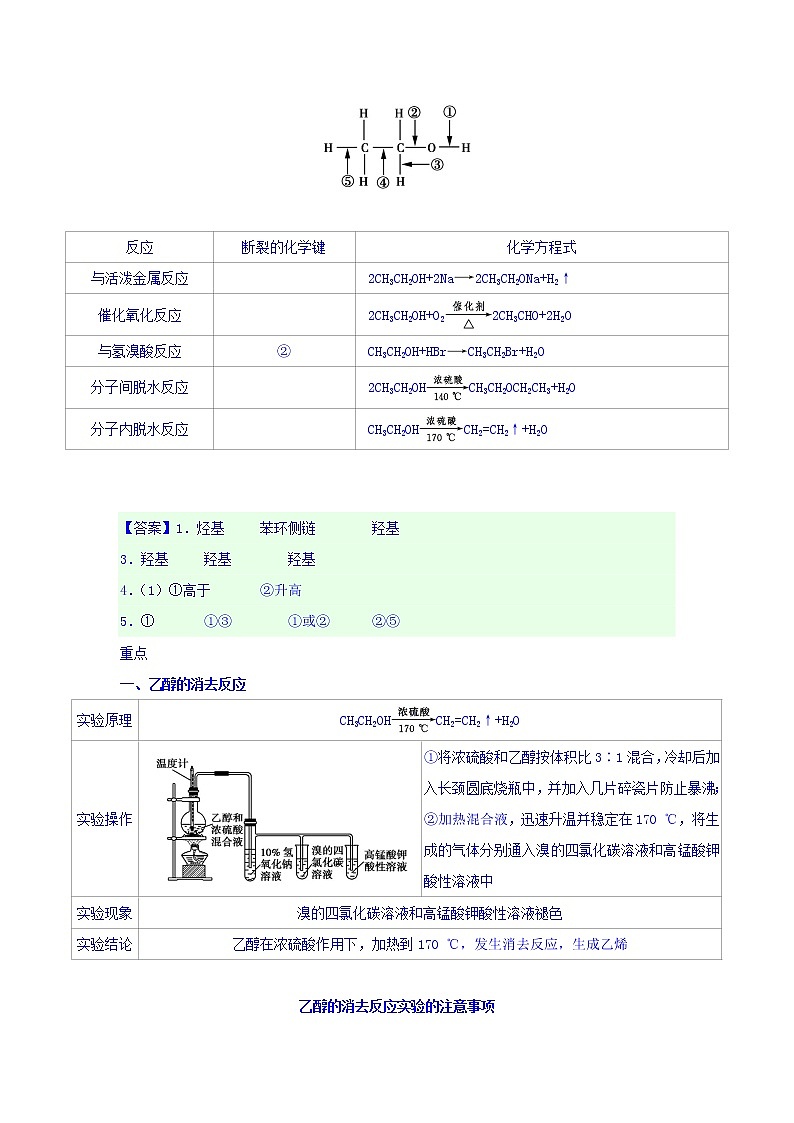
5.化学性质(以乙醇为例)
将乙醇分子中的化学键作如图所示标号,乙醇发生化学反应时化学键的断裂情况如下表所示:
【答案】1.烃基苯环侧链羟基
3.羟基羟基羟基
4.(1)①高于②升高
5.①①③①或②②⑤
重点
一、乙醇的消去反应
乙醇的消去反应实验的注意事项
(1)体积比为3∶1的浓硫酸与乙醇混合液的配制:在烧杯中先加入5 mL 95%的乙醇,然后滴加15 mL浓硫酸,边滴加边搅拌,冷却备用(相当于浓硫酸的稀释);在该反应中,浓硫酸是催化剂和脱水剂。
(2)加热混合液时,温度要迅速升高并稳定在170 ℃,因为温度在140 ℃时的主要产物是乙醚。
(3)因为参加反应的反应物都是液体,所以要向长颈圆底烧瓶中加入几片碎瓷片,避免液体受热时发生暴沸。
(4)温度计的水银球要置于混合液的中间位置。
(5)氢氧化钠溶液的作用是除去混在乙烯中的CO2、SO2等杂质,防止干扰乙烯与溴的四氯化碳溶液和高锰酸钾酸性溶液的反应。
实验室可用酒精、浓硫酸作试剂来制取乙烯,但实验过程中有许多副反应发生,如反应中会生成SO2、CO2、水蒸气等无机物。某研究性学习小组欲用如图所示的装置制备纯净的乙烯并探究乙烯与单质溴能否反应及反应类型。
请回答下列问题:
(1)写出制备乙烯的化学方程式:__________________________,实验中,混合浓硫酸与乙醇时是将_________慢慢加入另一种物质中;加热F装置时必须使液体温度_________________。
(2)写出浓硫酸与酒精直接反应生成上述无机副产物的化学方程式:______________________。
(3)为实现上述实验目的,装置的连接顺序为F→________________________→D。(各装置限用一次)
(4)当C中观察到____________时,表明单质溴能与乙烯反应;当D中____________时,表明C中发生的是取代反应;若D没有出现前面所描述的现象时,表明C中发生的是____________反应。
【思路点拨】根据反应中产生的气体杂质并结合题目的问题,去明晰每个装置的作用是解决问题的关键,特别是澄清石灰水和硝酸银溶液的作用,必须从题目问题中去寻找答案。
【解析】制备乙烯气体的反应就是乙醇的消去反应,生成物除乙烯外还有水。混合浓硫酸和乙醇的操作与实验室稀释浓硫酸的操作相同,即将浓硫酸慢慢加入乙醇中,实验室将其他液体和浓硫酸混合时,一般都是将浓硫酸慢慢加入另一液体中。加热时应使混合液温度迅速升高到170 ℃,目的是防止有副产物乙醚生成,从而影响乙烯的产率。为了得到纯净的乙烯气体,应用氢氧化钠溶液除去其中的CO2、SO2,再通过澄清石灰水,验证两种气体是否被除尽,然后用浓硫酸进行干燥。为了证明乙烯与溴发生的到底是加成反应还是取代反应,应将乙烯气体通过溴的四氯化碳溶液后,再通过硝酸银溶液,若乙烯与溴发生取代反应,则有溴化氢生成,通入硝酸银溶液将有淡黄色沉淀生成,若发生加成反应,则D试管中没有现象。
【答案】(1)CH3CH2OHCH2=CH2↑+H2O浓硫酸迅速升至170 ℃
(2)CH3CH2OH+6H2SO4(浓)2CO2↑+6SO2↑+9H2O
(3)A→B→E→C
(4)溶液褪色有淡黄色沉淀生成加成
二、醇的命名
1.一元醇的命名
选主链→选择含有与羟基相连的碳原子的最长碳链为主链,根据碳原子数目称为某醇
编碳号→从距离羟基最近的一端给主链上的碳原子依次编号定位
标位置→醇的名称前面要用阿拉伯数字标出羟基的位置;羟基的个数用“二”、“三”等汉字数字标出
,命名为5-甲基-3-乙基-2-己醇。
2.多元醇的命名
当分子中含多个羟基时,应选择含羟基最多的最长的碳链为主链,并从靠近羟基一端开始编号,当不可能将所有羟基都包含到同一主链时,应将羟基作为取代基。
下列关于有机物的命名正确的是
A.2-甲基-3-丁醇B.2,2-甲基丁烷C.2-乙基-1-丁烯D.间甲苯
【解析】解决此类问题的一般方法是先根据题给名称写出对应的结构简式,再按照命名规则重新进行命名,若与所给名称相同,则正确。A项未从离羟基最近一端对主链编号,错误。B项和D项均未注明甲基取代基的数目,错误。C项正确。
【答案】C
好题
1.在下列物质中,分别加入金属钠,不能产生氢气的是
A.蒸馏水B.无水乙醇C.煤油D.75%的酒精
2.比较乙烷和乙醇的结构,下列说法错误的是
A.两个碳原子以单键相连
B.分子里都含有6个相同的氢原子
C.乙基与一个氢原子相连就是乙烷分子
D.乙基与一个羟基相连就是乙醇分子
3.由羟基分别跟下列基团相互结合所构成的化合物中,属于醇类的是
A.B.C.D.
4.能证明乙醇分子中有一个羟基的事实是
A.乙醇完全燃烧生成CO2和H2O
B.0.1 ml乙醇与足量钠反应生成0.05 ml氢气
C.乙醇能溶于水
D.乙醇能脱水
5.甲醇、乙二醇、丙三醇中分别加入足量的金属钠产生等体积的氢气(相同条件),则上述三种醇的物质的量之比是
A.2:3:6B.3:2:1C.4:3:1D.6:3:2
6.乙醇分子中的化学键如图所示,下列关于乙醇在各种反应中断裂化学键的说法不正确的是
A.与金属钠反应时①断裂
B.在加热和铜作催化剂的条件下,与O2反应时①和③断裂
C.在加热和铜作催化剂的条件下,与O2反应时①和⑤断裂
D.发生酯化反应时①断裂
7.萜类物质中有许多都已被用于香料工业。常见的有如下几种结构(括号内表示④的结构简式):
①②③④
关于上述四种香料,下列说法正确的是
A.②和③均属于烯烃类B.①和③互为同分异构体
C.④是②的氧化产物D.③和④均能发生消去、酯化反应
8.将1 ml某饱和醇分成两等份,一份充分燃烧生成1.5 ml CO2,另一份与足量的金属钠反应生成5.6 L(标准状况)H2。这种醇分子的结构中除羟基氢外,还有两种不同的氢原子,则该醇的结构简式为
A.B.
C.CH3CH2CH2OHD.
9.某实验小组用如图所示装置进行乙醇催化氧化的实验。
(1)实验过程中铜网出现黑色和红色交替的现象,请写出相应的化学方程式__________________________、__________________________。在不断鼓入空气的情况下,熄灭酒精灯,反应仍能继续进行,说明乙醇的催化氧化反应是_____________ (填“吸热”或“放热”)反应。
(2)甲和乙两个水浴作用不相同。甲水浴的作用是__________________________;
乙水浴的作用是__________________________。
(3)反应进行一段时间后,试管a中能收集到不同的物质,它们主要是__________________________。集气瓶中收集到的气体的主要成分是__________________________。
(4)若试管a中收集到的液体能使紫色石蕊试纸显红色,说明收集到的液体中还含有__________________________。
10.乙醇的沸点是78 ℃,能与水以任意比混溶。乙醚的沸点为34.6 ℃,难溶于水,在饱和Na2CO3溶液中几乎不溶,乙醚极易燃烧。实验室制醚的反应原理是:
2CH3CH2OHH2O+CH3CH2—O—CH2CH3(乙醚)。实验装置如图所示。
请回答下列问题:
(1)甲和乙是两套实验室制乙醚的装置,选装置_______(填“甲”或“乙”)最合理,理由是______________。
(2)反应液中应加入沸石,其作用是______________。
(3)反应中温度计的正确位置是水银球置于_______。
(4)用装置乙制得的乙醚中可能含有大量的杂质,该杂质是_______,除去这种杂质的简易方法是_____________________ (提示:乙醚不溶于水,乙醇与水互溶)。
(5)如果温度太高,将会发生副反应,产物为_______。
参考答案
1.C 【解析】钠不能与煤油反应,但少量的钠可保存在煤油中。
2.B 【解析】乙烷()中6个氢原子等效,但乙醇()中有三种类型的氢:—CH3、—CH2—、—OH。
3.C 【解析】醇的结构要求是—OH与链烃基相连接,四个选项中只有C属醇类;A属羧酸,B、D属酚类。
4.B 【解析】乙醇与生成的氢气的物质的量之比为0.1∶0.05= 2∶1,说明乙醇分子中有一个活泼的氢原子可被金属钠取代(置换),即乙醇分子中有一个羟基。
5.D 【解析】本题考查醇与钠的反应,分别写出三种醇与钠反应的方程式,比较可得,三种醇的物质的量之比为6∶3∶2。
6.C 【解析】乙醇与钠反应生成乙醇钠,羟基中的O—H键断裂,A项正确;乙醇催化氧化生成乙醛,①和与羟基直接相连的碳原子上的C—H键即③断裂,B项正确,C项错误;发生酯化反应时,化学键①断裂,D项正确。
7.C 【解析】这四种结构中均含氧,不属于烯烃类,A错;①和③不是同分异构体,B错;④不能发生消去、酯化反应,D错。
8.A 【解析】据题意0.5 ml饱和醇充分燃烧生成1.5 mlCO2,可知其分子结构中含有3个碳原子;又知0.5 ml此醇与足量金属钠反应生成标准状况下的H2 5.6 L(即0.25 ml),可知其分子结构中含有一个羟基,则B、D选项不合题意;由于该醇分子的结构中除羟基氢外,还有两种不同的氢原子,可知A符合题意,C不合题意。
9.(1)2Cu+O22CuOCH3CH2OH+CuOCH3CHO+Cu+H2O放热
(2)加热冷却(3)乙醛、乙醇、水氮气(4)乙酸
【解析】甲水浴中的热水使乙醇变成蒸气,在空气的带动下进入硬质大试管,与热铜网接触,乙醇在CuO的催化作用下被O2氧化,生成乙醛。反应需要在加热的条件下进行,但熄灭酒精灯后,反应仍能继续进行,说明乙醇的催化氧化反应是放热反应。乙醛和未反应的乙醇及生成的水蒸气被乙水浴中的冷水冷却得到乙醛、乙醇和水的混合物;最后集气瓶中收集到的主要是没有参加反应的氮气 。试管a中收集到的液体能使紫色石蕊试纸显红色,说明液体中还含有酸性物质,应该是乙醛继续被氧化生成了乙酸。
10.(1)乙冷却效果好,乙醚远离火源
(2)防止暴沸
(3)反应物的液面下,但不能触及瓶底
(4)乙醇将其与饱和Na2CO3溶液混合,然后静置分液
(5)乙烯
【解析】(1)由题给信息知,乙醚的沸点非常低,装置乙冷却效果好,更易收集到乙醚。
(2)反应物均为液体,加热反应容易暴沸,应加入沸石。
(3)该反应需要控制的是反应混合液的温度,因此温度计主要测量的是反应混合液的温度,温度计的正确位置是水银球置于反应物的液面下,但不能触及瓶底。
(4)由于乙醇也易挥发,所以生成的乙醚中会混入乙醇。乙醇和水互溶,乙醚在饱和Na2CO3溶液中几乎不溶,所以可通过饱和碳酸钠溶液来除去乙醇。
(5)在170 ℃时乙醇会发生消去反应生成乙烯。
反应
断裂的化学键
化学方程式
与活泼金属反应
2CH3CH2OH+2Na2CH3CH2ONa+H2↑
催化氧化反应
2CH3CH2OH+O22CH3CHO+2H2O
与氢溴酸反应
②
CH3CH2OH+HBrCH3CH2Br+H2O
分子间脱水反应
2CH3CH2OHCH3CH2OCH2CH3+H2O
分子内脱水反应
CH3CH2OHCH2=CH2↑+H2O
实验原理
CH3CH2OHCH2=CH2↑+H2O
实验操作
①将浓硫酸和乙醇按体积比3∶1混合,冷却后加入长颈圆底烧瓶中,并加入几片碎瓷片防止暴沸;
②加热混合液,迅速升温并稳定在170 ℃,将生成的气体分别通入溴的四氯化碳溶液和高锰酸钾酸性溶液中
实验现象
溴的四氯化碳溶液和高锰酸钾酸性溶液褪色
实验结论
乙醇在浓硫酸作用下,加热到170 ℃,发生消去反应,生成乙烯
相关试卷
这是一份2020-2021学年第一节 合成高分子化合物的基本方法第1课时当堂达标检测题,共5页。试卷主要包含了5 ml氢气等内容,欢迎下载使用。
这是一份高中化学人教版 (新课标)选修5 有机化学基础第五章 进入合成高分子化合物的时代第一节 合成高分子化合物的基本方法第2课时课时训练,共6页。试卷主要包含了能从结构上区分醇和酚等内容,欢迎下载使用。
这是一份高中化学人教版 (新课标)选修5 有机化学基础第五章 进入合成高分子化合物的时代第一节 合成高分子化合物的基本方法第3课时同步测试题,共6页。试卷主要包含了下列物质哪些与互为同系物,苯酚和苯甲醇共同的化学性质是等内容,欢迎下载使用。