所属成套资源:人教版 (新课标)化学选修4 化学反应原理:全册试卷
高中化学人教版 (新课标)选修4 化学反应原理第一节 化学反应与能量变化第2课时同步练习题
展开
这是一份高中化学人教版 (新课标)选修4 化学反应原理第一节 化学反应与能量变化第2课时同步练习题,共4页。试卷主要包含了热化学方程式是,下列说法中不正确的是,由下图分析,有关叙述正确的是,已知,根据热化学方程式等内容,欢迎下载使用。
A.标明反应放热或吸热的式子
B.标明反应物和生成物聚集状态的式子
C.表示参加反应物质的量和反应热的关系的化学方程式
D.注明反应条件的化学方程式
2.下列说法中不正确的是( )
A.物质发生化学反应的反应热仅指反应放出的热量
B.热化学方程式中各物质的化学计量数只表示物质的量,不表示分子的个数
C.所有的燃烧都是放热反应
D.热化学方程式中化学式前面的化学计量数可以是分数
3.由下图分析,有关叙述正确的是( )
A.A―→B+C和B+C―→A两个反应吸收或放出的能量不等
B.A―→B+C是放热反应
C.A具有的能量高于B和C具有的能量总和
D.A―→B+C是吸热反应,则B+C―→A必然是放热反应
4.已知:①2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·ml-1 ;②H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·ml-1。下列说法中错误的是( )
A.①式表示25 ℃、101 kPa时,2 ml H2和1 ml O2完全燃烧生成2 ml H2O(l)放热571.6 kJ
B.2H2(g)+O2(g)===2H2O(g)中ΔH大于-571.6 kJ·ml-1
C.将含1 ml NaOH的水溶液与50 g 98%的硫酸混合后放出的热量为57.3 kJ
D.将含1 ml NaOH的稀溶液与含1 ml CH3COOH的稀溶液混合后放出的热量小于57.3 kJ
5.在测定中和热的实验中,下列说法正确的是( )
A.使用环形玻璃搅拌棒是为了加大反应速率,减小实验误差
B.为了准确测定反应混合溶液的温度,实验中温度计水银球应与小烧杯底部接触
C.用0.5 ml·L-1NaOH溶液分别与0.5 ml·L-1的盐酸、醋酸溶液反应,如所取的溶液体积相等,则测得的中和热数值相同
D.在测定中和热实验中需要使用的仪器有:天平、量筒、烧杯、滴定管、温度计
6.已知:H2(g)+F2(g)===2HF(g) ΔH=-270 kJ·ml-1,下列说法正确的是( )
A.氟化氢气体分解生成氢气和氟气的反应是放热反应
B.1 ml H2与1 ml F2反应生成2 ml液态HF放出的热量小于270 kJ
C.在相同条件下,1 ml H2与1 ml F2的能量总和大于2 ml HF气体的能量
D.该反应中的能量变化可用如图所示曲线来表示
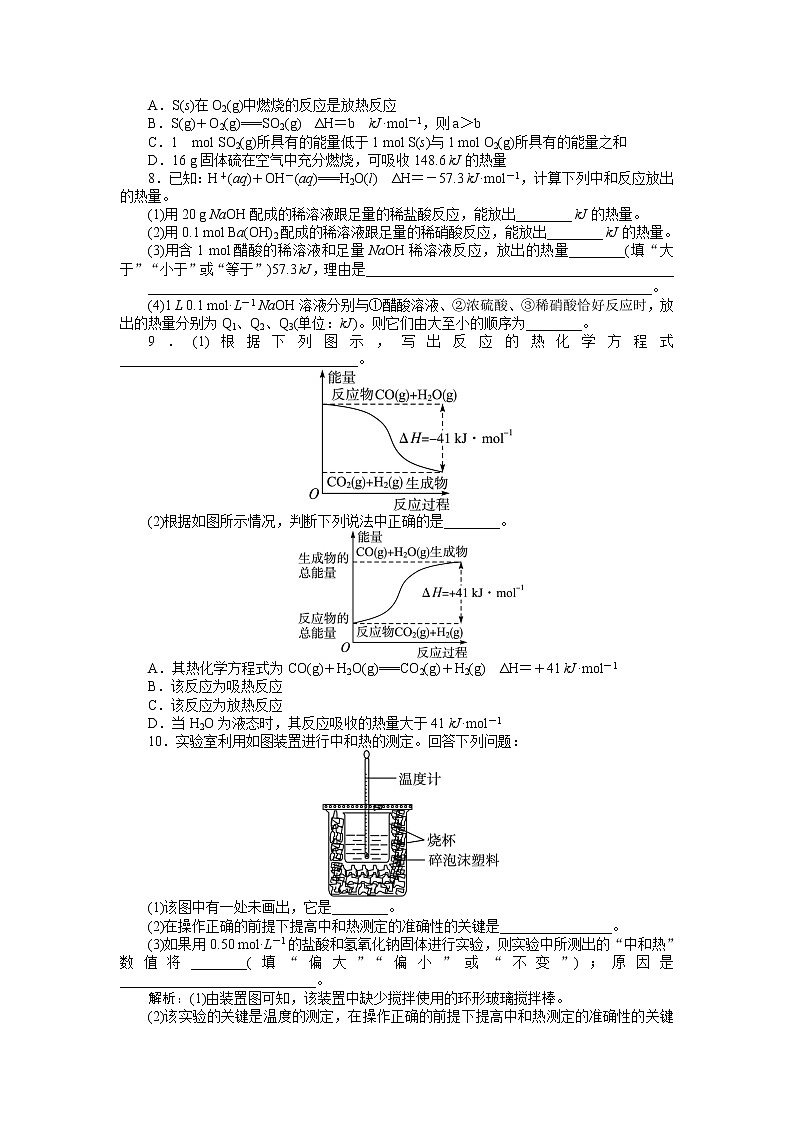
7.根据热化学方程式:S(s)+O2(g)===SO2(g) ΔH=a kJ·ml-1(a=-297.2)。分析下列说法,其中不正确的是( )
A.S(s)在O2(g)中燃烧的反应是放热反应
B.S(g)+O2(g)===SO2(g) ΔH=b kJ·ml-1,则a>b
C.1 ml SO2(g)所具有的能量低于1 ml S(s)与1 ml O2(g)所具有的能量之和
D.16 g固体硫在空气中充分燃烧,可吸收148.6 kJ的热量
8.已知:H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·ml-1,计算下列中和反应放出的热量。
(1)用20 g NaOH配成的稀溶液跟足量的稀盐酸反应,能放出________ kJ的热量。
(2)用0.1 ml Ba(OH)2配成的稀溶液跟足量的稀硝酸反应,能放出________ kJ的热量。
(3)用含1 ml醋酸的稀溶液和足量NaOH稀溶液反应,放出的热量________(填“大于”“小于”或“等于”)57.3 kJ,理由是____________________________________________
________________________________________________________________________。
(4)1 L 0.1 ml·L-1 NaOH溶液分别与①醋酸溶液、②浓硫酸、③稀硝酸恰好反应时,放出的热量分别为Q1、Q2、Q3(单位:kJ)。则它们由大至小的顺序为________。
9.(1)根据下列图示,写出反应的热化学方程式__________________________________。
(2)根据如图所示情况,判断下列说法中正确的是________。
A.其热化学方程式为CO(g)+H2O(g)===CO2(g)+H2(g) ΔH=+41 kJ·ml-1
B.该反应为吸热反应
C.该反应为放热反应
D.当H2O为液态时,其反应吸收的热量大于41 kJ·ml-1
10.实验室利用如图装置进行中和热的测定。回答下列问题:
(1)该图中有一处未画出,它是________。
(2)在操作正确的前提下提高中和热测定的准确性的关键是________________。
(3)如果用0.50 ml·L-1的盐酸和氢氧化钠固体进行实验,则实验中所测出的“中和热”数值将________(填“偏大”“偏小”或“不变”);原因是____________________________。
解析:(1)由装置图可知,该装置中缺少搅拌使用的环形玻璃搅拌棒。
(2)该实验的关键是温度的测定,在操作正确的前提下提高中和热测定的准确性的关键是提高装置的保温效果。
(3)因为固体NaOH溶于水放热,所以用0.50 ml·L-1的盐酸和氢氧化钠固体进行实验,则实验中所测出的“中和热”数值将偏大。
参考答案、
1. 解析:根据热化学方程式的含义可以判断只有C项正确。
答案:C
2. 解析:热化学方程式中各物质的化学计量数只表示物质的量而不表示分子个数。
答案:A
3. 解析:本题考查化学反应中的能量变化,由图可知,B和C的能量高于A的能量,则反应B+C―→A一定是放热反应,反之,A―→B+C则是吸热反应。根据能量守恒定律,两反应的反应热在数值上相等,符号相反。
答案:D
4. 解析:C项过程发生中和反应放出热量,同时伴随着浓硫酸稀释所放出的热量。
答案:C
5. 解析:在中和热的测定中,使用环形玻璃搅拌棒搅拌,目的是使反应物混合均匀,加快反应,减小误差,A正确;B项中,温度计水银球不能接触烧杯底部,B错误;C项中,CH3COOH为弱酸,电离吸热,故测得的中和热与用盐酸时数值不同,C错误;D项中仪器中不需要天平、滴定管,D错误。
答案:A
6. 解析:题给反应是放热反应,C项正确。
答案:C
7. 解析:由题中条件可知:反应的热效应ΔH=a kJ·ml-1=-297.2 kJ·ml-1,可知该反应的正向反应为放热反应,故D错误。
答案:D
8. 解析:由于CH3COOH电离要吸收热量,所以CH3COOH(aq)与NaOH(aq)中和放热要少些。浓硫酸稀释时放出大量热,所以(4)中Q2最大。
答案:(1)28.65 (2)11.46 (3)小于 醋酸电离需要吸热 (4)Q2>Q3>Q1
9. 解析:(2)以图示形式将反应CO2(g)+H2(g)===CO(g)+H2O(g)的物质变化和能量变化呈现出来,并要求判断反应类型及ΔH情况。根据所给图示可知,A选项将反应物与生成物弄反了,故不对;生成物的总能量比反应物的总能量高,故该反应为吸热反应,B选项正确,则C选项错误;D选项当H2O为液态时,反应吸收的热量将小于41 kJ·ml-1,故不对。答案为B。
答案:(1)CO(g)+H2O(g)===CO2(g)+H2(g) ΔH=-41 kJ·ml-1 (2)B
10. 答案:(1)环形玻璃搅拌棒
(2)提高装置的保温效果
(3)偏大 固体NaOH溶于水放热
相关试卷
这是一份2022年高三化学寒假自我小测:04化学反应与能量的变化(四) Word版含解析,共7页。试卷主要包含了6 ℃时变成硫蒸气S2,2C ΔH=-221,6 kJ 的热量, 是吸热反应,则CO是,已知,有如下三个热化学方程式等内容,欢迎下载使用。
这是一份2022年高三化学寒假自我小测:02化学反应与能量的变化(二) Word版含解析,共3页。试卷主要包含了下列说法中正确的是,下列过程一定释放出能量的是,下列对化学反应的认识错误的是等内容,欢迎下载使用。
这是一份2022年高三化学寒假自我小测:01化学反应与能量的变化(一) Word版含解析,共4页。试卷主要包含了下列关于反应能量的说法正确的,下列过程一定释放出能量的是,“摇摇冰”是一种即用即冷的饮料等内容,欢迎下载使用。